Изотопный состав - это относительное количество различных изотопов элемента в образце. Изотопы - это атомы одного и того же элемента, но с разным числом нейтронов в ядре. Из-за наличия различных изотопов у элементов, их атомы имеют различное массовое число.
Изотопы могут быть стабильными или нестабильными. Стабильные изотопы не подвергаются радиоактивному распаду, тогда как нестабильные изотопы радиоактивны и способны распадаться со временем.
Изотопный состав является важным показателем в различных областях науки, таких как радиоуглеродное датирование в археологии, изотопная геохимия, медицинская диагностика и др. Изменение изотопного состава может быть использовано для определения возраста образцов, исследования природных процессов и выявления неисправностей в организме.
Примеры таких элементов с несколькими изотопами включают углерод, кислород, уран и другие. Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14. Изотопный состав углерода-14 используется в радиоуглеродном датировании, чтобы определить возраст органических материалов.
Изотопный состав: определение и значение
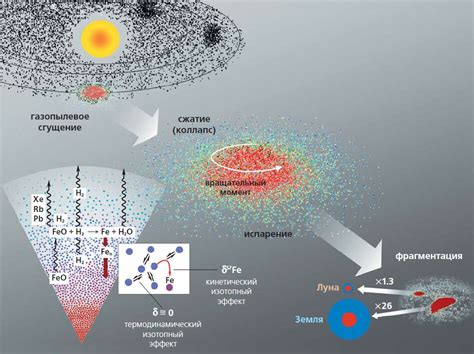
Изотопы могут различаться в массе, что оказывает влияние на физические и химические свойства элемента. Отличия в изотопном составе могут быть вызваны различными причинами, включая геологические процессы, астрофизические явления и человеческую деятельность.
Изотопный состав имеет большое значение в области науки и технологий. Например, анализ изотопного состава может быть использован для определения возраста археологических находок и геологических образцов, изучения происхождения и миграции веществ в биологических системах и окружающей среде, а также в ядерных исследованиях и медицине.
Некоторые примеры изотопного состава включают изотопы углерода, кислорода и водорода. Например, углерод имеет три изотопа: углерод-12, углерод-13 и углерод-14. Углерод-14 используется в археологии и геологии для определения возраста органических образцов. Кислород имеет три изотопа: кислород-16, кислород-17 и кислород-18. Кислород-18 используется в медицине для диагностики различных заболеваний. Водород также имеет три изотопа: водород-1, дейтерий и тритий. Дейтерий используется в ядерной энергетике и в качестве маркера в химических исследованиях.
Изотопный состав: общее понятие
Как правило, изотопы химические элементы отличаются лишь массовым числом. Изотопный состав обычно выражается в процентах, показывая, сколько процентов от всех атомов данного элемента составляет каждый из его изотопов.
Например, углерод имеет три изотопа: ^12C, ^13C и ^14C. Обычно углерод-12 составляет около 98,9% изотопного состава углерода, углерод-13 - около 1,1%, а углерод-14 - менее 0,1%. Эти значения могут варьироваться в зависимости от образца или среды, из которой взяты атомы углерода.
Изотопный состав имеет важное значение для многих научных и практических областей, таких как археология, геология, физика и медицина. Изменения в изотопном составе могут использоваться для определения происхождения и возраста материалов, изучения геологических процессов и климатических изменений, а также для диагностики и лечения различных заболеваний.
Значение изотопного состава в физике и химии

Изотопный состав играет важную роль в физике и химии, поскольку изотопы могут иметь различные химические и физические свойства. Это связано с тем, что информация о распределении изотопов вещества может быть использована для диагностики, анализа и совершенствования различных процессов и технологий.
В физике изотопный состав веществ играет роль в изучении ядерных реакций и радиоактивного распада. Изотопы используются в ядерной энергетике, в производстве радиоизотопных источников и в ядерных медицинских исследованиях. Изотопный состав может быть использован для определения возраста горных пород и археологических находок.
В химии изотопный состав веществ играет роль в исследовании реакций, катализаторов и в кинетических исследованиях. Изотопные метки могут быть использованы для отслеживания химических реакций и процессов в живых организмах, что помогает в понимании биохимических процессов и разработке новых лекарственных препаратов.
Например, изотопный состав углерода может быть использован в археологии для определения возраста органических материалов и изучения климатических изменений в прошлом. Изотопные метки кислорода могут быть использованы в медицине для диагностики и лечения заболеваний. Изотопный состав воды может быть использован для изучения водных ресурсов и цикла воды в природе.
Роль изотопного состава в геологии и астрофизике
Изотопный состав играет важную роль в геологии и астрофизике, помогая ученым понять и объяснить различные процессы и события, происходящие в природе.
В геологии изотопы используются для определения возраста горных пород и анализа истории геологических процессов. Изотопный анализ позволяет определить дату образования горных пород, а также изучить изменения в окружающей среде, такие как изменение климата или состояние океана. Например, изотопный анализ карбона 14 позволяет определить возраст органических материалов, таких как деревья или кости.
В астрофизике изотопный состав используется для изучения процессов, происходящих во вселенной. Изотопы элементов, найденные в космических образцах или в отдаленных галактиках, могут раскрыть тайны образования звезд и планет, а также историю развития вселенной. Например, изотопный анализ космических образцов помогает ученым изучать происхождение Солнечной системы и оценивать возраст планет и лун.
Таким образом, изотопный состав играет важную роль в изучении природы, а также помогает ученым лучше понять процессы, происходящие в геологии и астрофизике.
Изотопный состав: измерение и оценка

Для измерения изотопного состава применяются различные методы, основанные на разных принципах. Одним из таких методов является масс-спектрометрия. В этом методе проба подвергается ионизации, затем ионы разделяются в магнитном поле по их отношению массы к заряду, и, наконец, регистрируются детектором. Полученная масс-спектра позволяет определить относительное содержание разных изотопов.
Оценка изотопного состава проводится путем сравнения относительных содержаний изотопов в образце с известными значениями для стандартов. Величина, характеризующая отклонение изотопного состава образца от стандарта, называется дельта-значением. При этом использование масс-спектрометрии позволяет получить точные и надежные результаты о содержании изотопов в образце.
Примером применения изотопного состава является изучение окружающей среды. Например, анализ изотопов кислорода в ледяных кернах позволяет восстановить климатическую историю Земли. Анализ изотопов углерода в археологических находках может указывать на возраст предметов или источник их происхождения.
Методы измерения изотопного состава
Существует несколько методов измерения изотопного состава вещества:
1. Масс-спектрометрия: основан на разделении изотопов вещества по их массе и их последующем измерении. Этот метод позволяет определить изотопный состав с высокой точностью и дает возможность исследовать более тяжелые и редкие изотопы.
2. Ядерный магнитный резонанс: использует явление магнитного резонанса, которое происходит при взаимодействии атомных ядер с магнитным полем. По изменению частоты резонансного поглощения можно определить изотопный состав вещества.
3. Карбоновый анализ: применяется для измерения изотопного состава углерода. Основан на различии в изотопном составе углерода-12 и углерода-14. Метод широко используется в геологии, археологии и других научных областях.
4. Альфа-спектрометрия: основана на измерении энергии ионов в альфа-частицах после их прохождения через вещество. Этот метод позволяет определить изотопный состав элементов, таких как уран, торий и других радиоактивных веществ.
Каждый из этих методов имеет свои особенности и применяется в зависимости от конкретной задачи исследования.
Примеры изотопного состава в различных объектах
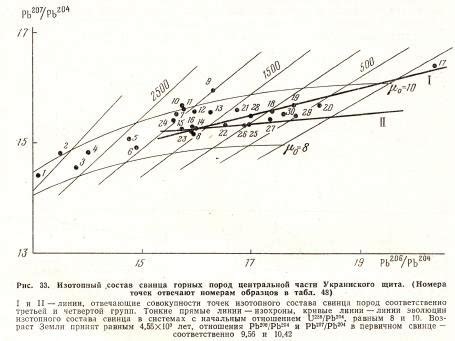
Изотопный состав может быть различным в различных объектах, таких как:
| Объект | Пример изотопного состава |
|---|---|
| Вода | Вода состоит из изотопов водорода - обычного водорода (1H) и дейтерия (2H). Обычно массовая доля дейтерия в воде составляет около 0,015%. |
| Углерод | Углерод имеет три стабильных изотопа - углерод-12 (12C), углерод-13 (13C) и углерод-14 (14C). Углерод-12 составляет около 98,9% массы углерода, углерод-13 - около 1,1%, а углерод-14 - очень низкая концентрация, так как является радиоактивным. |
| Уран | Уран состоит из нескольких изотопов, но самый распространенный и стабильный из них - уран-238 (238U). Его массовая доля составляет около 99,3%. Еще один изотоп урана - уран-235 (235U), который является радиоактивным и используется в ядерной энергетике и производстве ядерного оружия. |
Это лишь несколько примеров из разнообразия объектов и их изотопного состава. Анализ и изучение изотопного состава позволяет ученым получать информацию о происхождении и истории различных материалов и объектов.
Изотопный состав: изменение и причины
Изотопный состав может изменяться из-за различных физических и химических процессов. Некоторые из этих причин включают:
- Ядерный распад – это процесс, в ходе которого происходит изменение ядерного состава атомов. В результате этого процесса один изотоп может превращаться в другой изотоп или элемент.
- Оптические реакции – некоторые изотопы могут быть разделены с использованием оптических методов. Это происходит благодаря различиям в атомной массе и электромагнитных свойствах изотопов.
- Химические реакции – при химических реакциях могут происходить преференциальные изменения изотопного состава. Например, в реакциях фракционного изотопного обмена изотопы могут быть предпочтительно отделены в ходе процесса.
- Физические процессы – различные физические процессы, такие как диффузия, испарение и конденсация, могут также влиять на изотопный состав. Например, водяной пар с изотопом водорода, одиночным и двойным значением его массы, испаряется и конденсируется с разными скоростями в зависимости от изотопного состава, что может привести к изменению отношения изотопов в окружающей среде.
Понимание причин и механизмов изменения изотопного состава является важным для многих научных и прикладных областей. Это позволяет, например, изучать процессы в природных системах, включая геологические и климатические изменения, и использовать изотопный состав в различных научных исследованиях и технологиях.








