Молекулы - это основные структурные единицы всех веществ, состоящие из атомов, которые связаны между собой химическими связями. Однако, не менее важным фактором, влияющим на свойства и функции молекул, является их расположение. Различные конфигурации и пространственные устройства молекул определяют их стабильность, химическую активность, полезность в различных промышленных и биологических процессах.
Расположение молекул включает в себя такие понятия, как геометрическая форма, ориентация в пространстве и взаимное расположение атомов. Относительное положение атомов в молекуле может варьироваться от линейного до ветвистого, от плоского до трехмерного. Это влияет на физические и химические свойства молекулы, такие как температура плавления и кипения, растворимость, активность и т. д.
Примером значимости расположения молекул может служить молекула воды (H2O). Вода имеет уникальное расположение атомов, при котором два атома водорода связаны с одним атомом кислорода. Это приводит к образованию угла между атомами, равному примерно 104,5 градусов. Такое расположение молекулы воды обусловливает ее уникальные свойства, в том числе высокую плотность в жидком состоянии и возможность образования водородных связей.
Генетический код
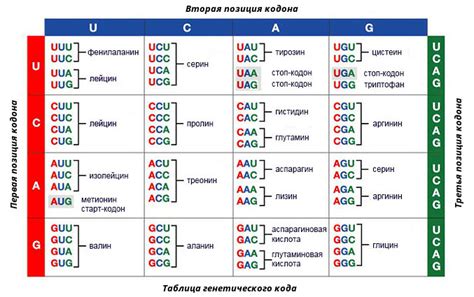
Генетический код состоит из трехнуклеотидных последовательностей, называемых кодонами. Каждый кодон специфицирует конкретную аминокислоту или сигнальный сигнал остановки трансляции. Всего существует 64 различных кодона.
Некоторые кодоны являются стартовыми кодонами, которые определяют начало перевода генетической информации в белок. Они также кодируют аминокислоту метионин. Остальные кодоны определяют различные аминокислоты и специальные сигналы, такие как стоп-кодоны, которые указывают на конец перевода.
Генетический код является универсальным, что означает, что большинство организмов используют одинаковый набор кодонов для определенных аминокислот. Кодон AUG считается универсальным старт-кодоном, а UGA, UAA и UAG - стоп-кодонами.
Изменения в генетическом коде, такие как мутации, могут приводить к изменению последовательности аминокислот в белке и, следовательно, к изменению его функции. Это может иметь серьезные последствия для организма, так как функциональные белки играют ключевую роль во многих биологических процессах.
Межмолекулярные взаимодействия
Существует несколько типов межмолекулярных взаимодействий, основные из которых включают следующее:
| Тип взаимодействия | Описание | Пример |
|---|---|---|
| Водородная связь | Связь между водородным атомом и электроотрицательным атомом (кислородом, азотом или фтором) в другой молекуле. | Водородная связь между молекулами воды, обусловливающая уникальные свойства воды, такие как высокая теплота парообразования и ковариантность. |
| Дисперсионное взаимодействие | Взаимодействие между неполярными молекулами, вызванное возникновением временных диполей. | Дисперсионные силы между молекулами воска, которые приводят к его устойчивости при комнатной температуре. |
| Ионно-дипольное взаимодействие | Взаимодействие между положительно заряженным ионом и полярной молекулой. | Ионно-дипольное взаимодействие между натриевым ионом и молекулой воды, обусловливающее растворение ионных соединений в воде. |
| Ван-дер-Ваальсово взаимодействие | Слабое взаимодействие между атомами или молекулами, вызванное дипольными и индуцированными дипольными моментами. | Ван-дер-Ваальсовы силы между молекулами метана, которые обуславливают его газообразное состояние при комнатной температуре. |
Межмолекулярные взаимодействия воздействуют на фазовые переходы вещества, растворимость, вязкость, поверхностное натяжение и другие свойства вещества. Понимание и управление этими взаимодействиями имеет большое значение для разработки новых материалов и молекулярных систем.
Поляризация молекул
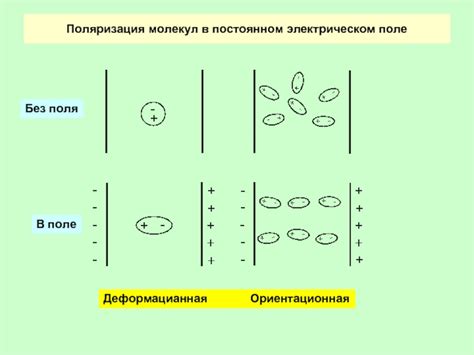
Поляризация молекул играет важную роль во многих химических и физических процессах. Например, взаимодействие поляризованных молекул определяет свойства многих веществ, включая силы межмолекулярного притяжения и растворимость. Поляризованные молекулы также играют важную роль в биологических системах, где они участвуют в межмолекулярных взаимодействиях и сигнальных процессах.
Одним из примеров поляризации молекул является образование диполя воды. В молекуле воды, атом кислорода электроотрицателен, поэтому электронная плотность смещена в его сторону. В результате, водная молекула становится полярной, с положительным зарядом на атоме водорода и отрицательным зарядом на атоме кислорода. Эта полярность позволяет молекулам воды взаимодействовать между собой через водородные связи и создавать такие особенности, как высокая теплота испарения и способность растворять многие вещества.
| Примеры поляризованных молекул | Описание |
|---|---|
| Хлорид натрия (NaCl) | Молекула NaCl состоит из ионов натрия и хлора, которые образуют кристаллическую решетку с полярными связями между ионами. |
| Аммиак (NH3) | В молекуле аммиака, атом азота электроотрицателен и создает полярную связь с атомами водорода. |
| Этилен (C2H4) | В молекуле этилена существуют две двойные связи между атомами углерода, что приводит к поляризованности молекулы. |








