Кинетическая энергия молекул является одним из основных понятий в физике и химии. Она определяется как энергия движения молекул вещества. Кинетическая энергия напрямую связана с температурой и скоростью частиц. Чем выше температура, тем больше кинетическая энергия молекул.
Представление о кинетической энергии молекул обязательно при изучении различных физических процессов и явлений в химии и термодинамике. Она играет важную роль в объяснении таких физико-химических явлений, как испарение, диффузия и химические реакции. Кинетическая энергия молекул также влияет на физические свойства вещества, такие как плотность, вязкость и теплоемкость.
Значение кинетической энергии молекул трудно переоценить. Она определяет свойства вещества, его поведение и взаимодействие с окружающей средой. В современной науке широко используются методы, основанные на понимании кинетической энергии молекул, такие как молекулярно-кинетическая теория и молекулярно-динамическое моделирование.
В заключение, кинетическая энергия молекул является одной из ключевых концепций в физике и химии. Она играет существенную роль в объяснении физических явлений и влияет на свойства вещества. Понимание и изучение кинетической энергии молекул открывают новые возможности в науке и технологиях, позволяя нам лучше понять и контролировать мир, который нас окружает.
Что такое кинетическая энергия молекул?

Кинетическая энергия, как и другие формы энергии, измеряется в джоулях (Дж). Она прямо пропорциональна массе и скорости движения молекулы: чем больше масса молекулы и ее скорость, тем больше ее кинетическая энергия.
Кинетическая энергия молекул является ключевым показателем для объяснения физических свойств вещества. Она влияет на такие явления, как теплоемкость вещества, его фазовые переходы и пластическое деформирование.
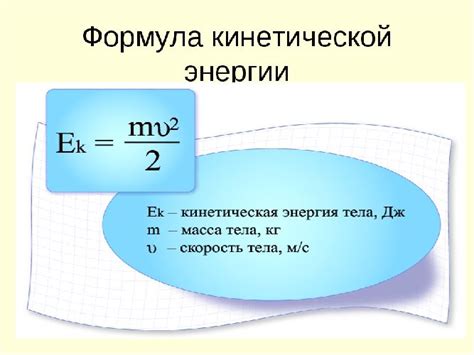
Для расчета кинетической энергии молекулы необходимо знание ее массы и скорости. Формула для вычисления кинетической энергии выглядит следующим образом:
| Формула | Описание |
|---|---|
| E = 1/2 * m * v^2 | Кинетическая энергия молекулы (E) равна половине произведения ее массы (m) на квадрат скорости (v) движения. |
Изучение кинетической энергии молекул позволяет понять механизмы взаимодействия вещества на молекулярном уровне и прогнозировать его свойства при различных условиях.
Определение и объяснение основного понятия
Кинетическая энергия молекул может быть выражена в формуле:
К.Э. = 1/2 * m * v^2
Где:
- К.Э. - кинетическая энергия;
- m - масса молекулы;
- v - скорость движения молекулы.
Как измеряется кинетическая энергия молекул?
Один из методов измерения кинетической энергии молекул – это использование термодинамических данных. В этом методе измерения используется известное значение энтальпии или теплоты реакции, связанной с движением молекул. Измерение кинетической энергии молекул в этом случае может быть выполнено с помощью теплового баланса или специального калориметра.
Другой метод измерения кинетической энергии молекул – это использование физических законов и формул. Например, скорость молекул можно измерить с помощью специального прибора, такого как анализатор масс-спектрометра или детектор скорости тепловых молекул. Зная массу молекулы и ее скорость, можно рассчитать кинетическую энергию по формуле.
Также, основанное на физических принципах, измерение кинетической энергии молекул может быть выполнено с использованием метода диффузии газа или метода распределения скоростей молекул в газе. Эти методы позволяют определить среднюю кинетическую энергию молекул, а также ее зависимость от температуры и других факторов.
Таким образом, измерение кинетической энергии молекул является важным в физике и химии, и может быть выполнено с использованием различных методов и приборов.
Значение кинетической энергии молекул в химических реакциях
Кинетическая энергия молекул играет важную роль в химических реакциях. Она определяет скорость реакций, способность молекул взаимодействовать и приводить к образованию новых веществ.
При химической реакции, молекулы перемещаются и сталкиваются друг с другом. При столкновении, молекулы могут передать кинетическую энергию друг другу, что приводит к изменению их движения и скорости. Чем больше кинетическая энергия молекул, тем больше вероятность, что они взаимодействуют и приведут к химической реакции.
Кинетическая энергия молекул также влияет на энергетику химической реакции. При столкновении молекул, энергия межмолекулярных связей может быть разорвана, что приводит к образованию новых связей и образованию новых веществ. Высокая кинетическая энергия молекул способствует разрыву связей и образованию продуктов реакции.
Определение и контроль кинетической энергии молекул имеют огромное значение для понимания и управления химическими реакциями. Использование энергии в процессе реакции может быть оптимизировано, чтобы ускорить или замедлить скорость реакции, получить определенные продукты и увеличить выход продуктов реакции.
Таким образом, понимание значения кинетической энергии молекул в химических реакциях позволяет улучшить процессы синтеза, оптимизировать условия проведения реакции и разрабатывать новые методы получения веществ.
Как кинетическая энергия молекул связана с фазовыми переходами?

При увеличении кинетической энергии, молекулы начинают занимать более хаотические позиции, что приводит к плавлению твердого вещества или испарению жидкости. В этом случае, молекулы переходят из упорядоченного состояния в более хаотичное состояние, что приводит к изменению фазы вещества.
С другой стороны, при уменьшении кинетической энергии, молекулы замедляются и начинают формировать более упорядоченные структуры, что приводит к конденсации пара или затвердеванию жидкости. В этом случае, молекулы переходят из более хаотичного состояния в более упорядоченное состояние, что также приводит к изменению фазы вещества.
Таким образом, кинетическая энергия молекул является определяющим фактором фазовых переходов. Изменение кинетической энергии вещества вызывает изменение движения его молекул и приводит к изменению фазы вещества. Отслеживание и понимание кинетической энергии молекул является ключевым аспектом изучения фазовых переходов и их значимости в физической и химической науке.
Использование кинетической энергии молекул в технологических процессах
Одним из примеров использования кинетической энергии молекул в технологических процессах является техника нагрева. Путем увеличения кинетической энергии молекул вещества до определенной температуры, происходит значительный рост скорости химических реакций и процессов. Это позволяет получать продукт высокого качества за более короткое время и снижает энергозатраты на производство.
Еще один пример использования кинетической энергии молекул в технологических процессах - техника кондиционирования воздуха. Путем контролируемого изменения кинетической энергии молекул воздуха можно достичь оптимальных условий для поддержания комфортной температуры и влажности в помещении. Такая техника активно применяется в зданиях офисов, жилых комплексах, торговых центрах и других объектах, где комфортное пребывание людей является приоритетом.
Также кинетическая энергия молекул применяется в технологических процессах, связанных с перемещением грузов. Например, в основе работы лифтовов и эскалаторов лежит использование кинетической энергии молекул для передвижения кабин и ступеней. Такая техника позволяет обеспечить эффективное и безопасное перемещение людей и грузов по вертикальным и горизонтальным линиям.
В заключение, кинетическая энергия молекул играет важную роль в технологических процессах. Она позволяет оптимизировать различные процессы благодаря увеличению скорости реакций, поддержанию комфортной среды и обеспечению эффективной транспортировки грузов. Развитие технологий и появление новых методов использования кинетической энергии молекул открывают перспективы для улучшения энергоэффективности и качества производства в различных отраслях промышленности.








