Вода является одним из самых известных и широко используемых растворителей. Ее уникальные свойства исходят из особенностей молекулярной структуры. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Эти атомы связаны друг с другом с помощью ковалентных связей. Каждый атом водорода образует связь с атомом кислорода, образуя угловую структуру.
Одной из особенностей молекулы воды является ее полярность. Кислородный атом имеет большую электроотрицательность, поэтому он притягивает электроны от атомов водорода ближе к себе. Это создает разницу в заряде внутри молекулы воды: одна сторона молекулы становится частично отрицательной, а другая – частично положительной. Такая полярность делает молекулу воды отличным растворителем для многих веществ, особенно для других полярных соединений.
При контакте с полярными веществами молекулы воды образуют водородные связи. Водородные связи – это слабое притяжение между молекулами воды, которое образуется в результате притяжения положительно заряженного водородного атома одной молекулы к отрицательно заряженному кислороду другой. Это приводит к образованию сети водородных связей, которая придает воде многие уникальные свойства.
Благодаря водородным связям молекулы воды способны перемещаться и образовывать структуры с различными агрегатными состояниями. При низких температурах эти связи делают молекулы воды более упорядоченными, образуя лед. По мере нагревания молекулы воды приобретают большую энергию, что приводит к разрушению водородных связей и переходу воды из твердого состояния в жидкое и газообразное состояния.
Растворительные свойства воды: особенности молекул

Однако особенностью молекул воды является их полярность. Водные молекулы имеют слегка отрицательно заряженные кислородные атомы и слегка положительно заряженные водородные атомы. Это приводит к образованию водородных связей между молекулами воды.
Водородные связи являются слабыми, но численно проявляют большую прочность. Они обеспечивают способность молекул воды образовывать кластеры и образовывать структуру жидкости. Благодаря этим водородным связям, вода обладает высокой теплотой парообразования и плавления, а также высокой теплоемкостью.
Полярность молекул воды также обеспечивает ее способность растворять различные вещества. Отрицательно заряженные частицы, такие как ионы или полярные молекулы, легко растворяются в воде, так как они притягиваются к положительно заряженным водным молекулам. Вода также способна растворять некоторые неполярные молекулы, но в этом случае растворение происходит за счет образования гидратных оболочек вокруг молекулы.
Кроме того, водные молекулы обладают поверхностным натяжением. Это связано с их способностью образовывать пленки, которые удерживают небольшие объекты на поверхности воды. Это явление объясняется наличием дополнительных водородных связей между водными молекулами в пленках.
Таким образом, растворительные свойства воды обусловлены особенностями ее молекул. Полярность молекул и возможность образования водородных связей делают воду отличным растворителем для широкого спектра веществ, что играет важную роль в биологических и химических процессах.
Структура молекул воды и ее значения
Молекула воды состоит из двух атомов водорода и одного атома кислорода, связанных друг с другом. Эта трехатомная структура обеспечивает уникальные свойства воды.
Атом кислорода в молекуле воды обладает отрицательным зарядом, а атомы водорода - положительными зарядами. Это приводит к образованию диполя, где одна часть молекулы становится частично электронейтральной (отрицательной), а другая - частично положительной. Благодаря этому диполю, вода обладает способностью образовывать водородные связи, которые придают ей уникальные свойства растворителя.
Водородная связь - слабая силовая взаимодействие между молекулами воды, основанное на притяжении положительно заряженного атома водорода одной молекулы к отрицательно заряженному атому кислорода другой молекулы. Это приводит к высокой теплопроводности, поверхностному натяжению и большой теплоемкости воды.
Структура молекул воды также играет важную роль в ее значении для живых организмов. Для большинства жизненно важных процессов, таких как растворение и транспорт питательных веществ, регуляция температуры и поддержание формы клеток, необходима участие воды. Ее способность образовывать водородные связи позволяет воде выполнять эти функции эффективно и эффективно. Без воды жизнь, как мы ее знаем, была бы невозможна.
Полярность молекулы воды как ключевой фактор растворения
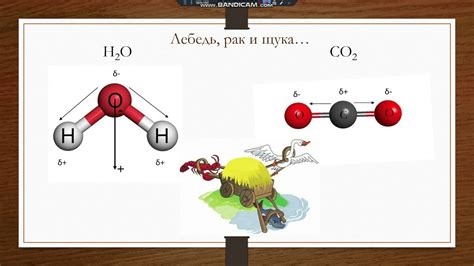
Полярность молекулы воды играет важную роль в ее способности растворять другие вещества. Водная молекула состоит из двух атомов водорода и одного атома кислорода, которые связаны между собой ковалентной связью. Однако, электроны водной молекулы не равномерно распределены, что приводит к созданию полярной структуры.
Атом кислорода в молекуле воды имеет большую электроотрицательность, чем атомы водорода. Это означает, что атом кислорода притягивает электроны к себе сильнее, образуя отрицательно заряженную область. В то же время, атомы водорода имеют частично положительные заряды.
Этот разделение зарядов делает молекулу воды полярной. Такая полярность позволяет молекулам воды взаимодействовать с другими полярными и ионными молекулами. Водные молекулы могут выстраиваться вокруг положительно или отрицательно заряженных ионов, образуя гидратные оболочки. Это явление называется сольватацией.
Из-за своей полярности, вода может растворять также множество полярных молекул, таких как сахара, кислородные соединения и аминокислоты. Когда полярная молекула попадает в воду, она разделяется на единицы, называемые ионами или молекулами, которые образуют оболочку гидратации, а следовательно растворяются. Вода является всеобъемлющим растворителем для таких веществ.
Однако, неполярные молекулы, такие как масла и жиры, не могут быть растворены в воде из-за их отсутствия полярности. Такие молекулы не имеют возможности образовывать взаимодействия с полярными молекулами воды и, следовательно, они не растворяются.
Гидратация и специфические особенности воды в растворении
Одной из особых особенностей воды в растворении является ее способность формировать водородные связи с другими молекулами. Водородные связи обеспечивают структурную устойчивость гидратов и способствуют их стабильности.
Кроме того, вода обладает положительно-заряженными и отрицательно-заряженными концами, что позволяет ей образовывать ионы растворенных веществ. Таким образом, вода способна образовывать специфические соединения с растворенными веществами, воздействуя на их структуру и свойства.
Вода также обладает высокой плотностью и теплопроводностью, что важно для многих процессов растворения. Ее способность принимать различные состояния в зависимости от температуры позволяет регулировать скорость растворения и влиять на характеристики получаемых растворов.
В итоге, гидратация и специфические особенности воды в растворении позволяют ей успешно взаимодействовать с различными веществами, обеспечивая процессы растворения и наличие разнообразных растворов, что является необходимым для многих биологических и химических реакций.








