Вода - удивительное вещество, которое играет важную роль в жизни на Земле. Она не только обеспечивает наше существование, но и способна растворять множество различных веществ. Взаимодействие воды с разными веществами создает уникальные химические реакции, которые имеют большое значение для функционирования природных экосистем.
Вода является универсальным растворителем, благодаря своим химическим и физическим свойствам. Она способна растворять множество органических и неорганических веществ. В природе вода растворяет такие вещества, как минералы, соли, газы, кислоты, щелочи, а также некоторые органические соединения.
Некоторые из примеров веществ, которые растворяются в воде, включают сахар, соль, соляную кислоту, углекислый газ, аммиак, уксусную кислоту, йод и множество других. Вода также способна растворять биологически активные вещества, такие как витамины, аминокислоты и ферменты, что делает ее незаменимой для множества жизненно важных процессов, происходящих в организмах.
Вода и её растворимость в природе: основные свойства и примеры

Одно из основных свойств воды - её полюсность. Молекула воды состоит из двух атомов водорода и одного атома кислорода. Атомы водорода обладают положительным зарядом, а атом кислорода - отрицательным. Это создает полюсную структуру молекулы воды, которая обуславливает её способность растворять различные вещества.
Вода растворяет многочисленные соли, кислоты и щелочи. Например, в природе вода растворяет минералы, содержащиеся в почве и горных породах. При этом она обогащается различными элементами и ионами, что является важным фактором для живых организмов.
Также вода растворяет газы, такие как кислород и углекислый газ. Это позволяет им распространяться в природной среде и обеспечивать жизнедеятельность растений и животных.
Вода также способна растворять органические вещества, такие как сахар и спирт. Это обусловлено взаимодействием молекулы воды с органическими соединениями, что позволяет им быть транспортированными в организмах и участвовать в различных физиологических процессах.
Таким образом, растворимость воды в природе является важным свойством, которое обеспечивает перемещение и обмен веществ в биосфере. Вода способна растворять разнообразные вещества, что позволяет ей выполнять свои разносторонние функции в природных процессах.
Химическое составление воды и её растворимость
Растворимость - это свойство вещества растворяться или не растворяться в другом веществе, формируя равномерную смесь - раствор. Так как вода является наиболее распространенным растворителем на Земле, её способность растворять различные вещества является крайне важной для многих процессов в природе и для жизнедеятельности организмов.
Вода растворяет в себе огромное количество веществ, включая растворимые соли, газы, органические и неорганические вещества. Некоторые из наиболее известных растворимых веществ в воде:
- Сахар
- Соль (хлорид натрия)
- Кислород (в виде газа или в составе оксидов)
- Углекислый газ
- Серная кислота
- Аммиак
- Мочевина
- Метанол
- Этанол
Также вода может растворять органические соединения, такие как спирты, сахара, кислоты, аминокислоты и другие биологически активные вещества.
Растворимость веществ в воде обусловлена их взаимодействием с молекулами воды. Вода является полярным растворителем, что означает, что она обладает частично заряженными частицами (полярность). Это позволяет ей эффективно взаимодействовать с другими полярными и ионными веществами, притягивая их молекулы и разделяя их на ионы или молекулы, которые отдельно растворяются в воде.
Основные физические свойства воды и её влияние на растворимость

Вода также обладает высокой теплоёмкостью и теплопроводностью. Это означает, что она может аккумулировать большое количество тепла и передавать его. Эти свойства влияют на растворимость веществ, поскольку водные растворы могут охлаждаться или нагреваться медленнее, чем другие растворители.
Кроме того, вода обладает поверхностным напряжением. Это явление объясняется силами притяжения молекулы воды друг к другу, в результате чего образуется «пленка» на поверхности воды. Поверхностное напряжение воды может снижать растворимость некоторых веществ, так как оно может предотвращать полное смешивание молекул растворимого вещества.
Также следует отметить, что вода является унисолярным растворителем. Это значит, что она сама может растворяться в других растворимых веществах, образуя гомогенные смеси. Это важное свойство влияет на способность воды растворять другие вещества и повышать их растворимость.
Благодаря перечисленным физическим свойствам, вода является универсальным растворителем в природе. Она способна растворять большинство ионных и полярных веществ, таких как соли, кислоты, щелочи, сахара и другие органические и неорганические соединения.
Растворимость неорганических веществ в воде
Ниже приведен перечень неорганических веществ, которые хорошо растворяются в воде:
- Соли: калия, натрия, кальция, магния, железа и других металлов. Примеры растворимых солей - хлорид натрия (NaCl), сульфат магния (MgSO4), нитрат калия (KNO3) и др.
- Кислоты: серной, соляной, уксусной, солярки и другие. Эти кислоты растворяются в воде и образуют ионы водорода (H+).
- Основания: щелочи, гидроксиды металлов. Примеры растворимых оснований - гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид кальция (Ca(OH)2) и др.
- Газы: кислород, азот, углекислый газ и другие растворимы в воде газы, которые могут образовывать кислотные или щелочные растворы при взаимодействии с водой.
- Неорганические соединения: некоторые оксиды металлов (например, оксид кальция CaO), некоторые фосфаты, нитраты, сульфиды и др.
Это лишь небольшая часть неорганических веществ, которые растворяются в воде. Растворимость зависит от множества факторов, включая температуру, давление и растворимость вещества самого по себе.
Растворимость органических веществ в воде
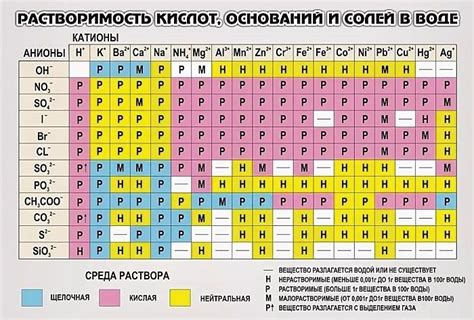
Вода обладает высокой растворимостью в широком спектре органических соединений, таких как спирты, карбонильные соединения, аминокислоты и сахара. Некоторые из наиболее распространенных органических веществ, растворимых в воде, включают:
- Этанол (спирт) - часто используется в медицине, косметике и химической промышленности.
- Глицерин - широко применяется в фармацевтической, пищевой и косметической промышленности.
- Уксусная кислота - часто используется в пищевой промышленности и в бытовых условиях.
- Лимонная кислота - присутствует во многих фруктах и овощах, используется в пищевой и фармацевтической промышленности.
- Аскорбиновая кислота (витамин C) - необходимая часть питания человека, широко используется в пищевой и фармацевтической промышленности.
Среди органических веществ, плохо растворимых в воде, можно выделить жиры и масла, некоторые углеводы (например, целлюлоза) и большинство органических полимеров (пластиков).
Растворимость органических веществ в воде играет важную роль в жизни на Земле. Она определяет способность веществ распространяться в окружающей среде, быть доступными для организмов и участвовать в химических реакциях.
Реакция между веществами и водой
Основными примерами реакций между веществами и водой являются:
1. Реакция между кислотами и водой: многие кислоты реагируют с водой, образуя ионы водорода (H+) и ионы гидроксида (OH-). Например, хлороводородная кислота (HCl) реагирует с водой, образуя ион H3O+ и хлоридные ионы (Cl-).
2. Реакция между щелочами и водой: щелочи, такие как натрий гидроксид (NaOH), реагируют с водой, образуя ионы гидроксида (OH-) и ионы металла (Na+). В результате образуется щелочное растворение. Например, реакция натрий гидроксида и воды:
2 NaOH + H2O → 2 Na+ + 2 OH-
3. Реакция между солями и водой: некоторые соли растворяются в воде, диссоциируя на положительные ионы (катионы) и отрицательные ионы (анионы). Например, хлорид натрия (NaCl) растворяется в воде, образуя натриевые ионы (Na+) и хлоридные ионы (Cl-).
4. Реакция между газами и водой: некоторые газы могут реагировать с водой при образовании различных химических соединений. Например, диоксид углерода (CO2) растворяется в воде, образуя угольную кислоту (H2CO3), которая диссоциирует на ионы водорода и ионы карбоната (H+ и HCO3-).
Это лишь несколько примеров реакций между веществами и водой. Взаимодействие воды с другими веществами имеет важное значение для многих химических процессов, происходящих в живых организмах и в природе в целом.
Расширенные примеры растворимости в воде

- Сахар (сахароза) - одно из самых распространенных веществ, которое полностью растворяется в воде.
- Соль (хлорид натрия) - эта субстанция также хорошо растворяется в воде. Это объясняет, почему вкусовое ощущение соли так сильно выражено в многих пищевых продуктах.
- Магний - магниевые соли, такие как хлорид магния или сульфат магния, имеют высокую степень растворимости в воде.
- Карбонат кальция - растворимость этого соединения в воде зависит от концентрации углекислого газа, присутствующего в воде. При высокой концентрации углекислого газа карбонат кальция может легко растворяться, образуя карбонатные и бикарбонатные ионы.
- Серная кислота - одна из сильнодействующих кислот, полностью растворяющихся в воде.
- Этиленгликоль - органическая жидкость, широко используемая в промышленности, полностью растворяется в воде.
Это лишь небольшой перечень веществ, являющихся примерами растворимости в воде. Вода самый распространенный растворитель в природе и способна растворять множество различных веществ, что делает ее основой для многих химических реакций и процессов.
Сферы использования растворимости в воде
| Сфера использования | Примеры |
|---|---|
| Питьевая вода | Различные минералы и соли, содержащиеся в природных и искусственных источниках воды, растворяются и делают ее пригодной для употребления человеком. |
| Производство пищевых продуктов | Растворимость в воде используется при приготовлении различных блюд и напитков, в процессе производства сиропов, консервов, маринадов и других продуктов. |
| Фармацевтическая промышленность | Вода играет важную роль в процессе производства лекарственных средств, так как большинство активных веществ растворимы в воде и именно с ее помощью осуществляется их дальнейшая обработка и применение. |
| Индустрия красителей | Многие красители растворимы в воде, и их растворы используются в текстильной, пищевой, косметической и других отраслях промышленности. |
| Энергетика | Растворимость в воде используется при производстве электроэнергии в гидроэлектростанциях, а также в процессе получения различных видов топлива, таких как водород и горючие смеси. |
| Бытовая химия | Многие бытовые растворимые химические продукты, такие как моющие средства, средства для мытья посуды и стирки белья, основаны на водных растворах. |
Вода как растворитель имеет широкое применение в разных отраслях жизни и производства, обеспечивая возможность растворения и использования различных веществ.
Значимость знания растворимости в воде в природе и обществе

В природе вода играет ключевую роль во многих биологических и геологических процессах. Растворимость веществ в воде определяет их доступность и доступность для живых организмов. Например, вода способна растворять соли, минералы и другие питательные вещества, необходимые для роста растений. Растворимость в воде также влияет на подвижность и доступность почвенных элементов, что важно для сельского хозяйства и продовольственной безопасности.
Вода также является средой для многих химических реакций и процессов в обществе. Например, многие лекарственные препараты и химические вещества растворяются в воде для обеспечения их эффективного действия в организме человека. Растворимость в воде также важна для процессов очистки воды от загрязнений и химических веществ, что является основой для обеспечения чистой питьевой воды для населения.
Знание о растворимости в воде позволяет предсказывать поведение веществ в различных средах и условиях. Оно является основой для разработки новых материалов, технологий и методов, которые в свою очередь способствуют улучшению качества жизни людей и сохранению природных ресурсов.
Важно понимать, что растворимость в воде – это не статичное свойство, а зависит от многих факторов, таких как температура, давление и наличие других растворенных веществ. Поэтому исследование и понимание растворимости в воде является постоянным объектом научных исследований и до сих пор представляет большой интерес для ученых и специалистов различных областей.








