Химические реакции - это процессы, в которых происходят изменения состава и структуры вещества. Они играют важную роль во многих ежедневных процессах, начиная от пищеварения в нашем организме и заканчивая работой машин и производством материалов. Понимание условий протекания химических реакций является ключом к контролю этих процессов и разработке новых технологий.
Условия протекания химических реакций включают различные факторы, которые могут влиять на скорость и направление реакции. Одним из основных факторов является концентрация реагентов - количество вещества, участвующего в реакции. Чем выше концентрация, тем больше возможностей для молекул встретиться и взаимодействовать, что приводит к более быстрой реакции.
Температура является еще одним важным фактором условий протекания химической реакции. При повышении температуры увеличивается энергия молекул, что способствует более эффективному столкновению и перераспределению энергии, необходимой для протекания реакции. Кроме того, температура может влиять на стабильность реагентов и продуктов реакции, определяя их способность протекать.
Другим важным фактором является наличие катализаторов - веществ, которые повышают скорость реакции, не изменяя самой реакции. Они облегчают взаимодействие реагентов, снижают энергетический барьер, необходимый для реакции и повышают эффективность протекания реакции. Катализаторы могут быть как природные вещества, так и разработанные человеком.
И наконец, pH раствора, в котором происходит реакция, также может оказывать влияние на протекание химической реакции. pH раствора определяется концентрацией ионов водорода в растворе и может изменять активность ионов, участвующих в реакции. Изменение pH может привести к изменению электрического заряда реагентов, что может повлиять на их способность взаимодействовать и протекать реакцию.
Все эти факторы условий протекания химических реакций взаимосвязаны и могут влиять друг на друга. Понимание и контроль этих условий позволяют управлять реакциями и прогнозировать их ход, что является фундаментальной основой для многих научных и технических открытий в области химии и других наук.
Температура и химические реакции

Повышение температуры обычно приводит к увеличению скорости химической реакции. Это связано с тем, что при повышении температуры молекулы и ионы получают больше энергии, что способствует их взаимодействию. В результате частицы сталкиваются чаще и с большей энергией, что увеличивает вероятность успешного столкновения и, следовательно, скорость реакции.
Однако есть и исключения. В некоторых случаях повышение температуры может вызывать обратное действие и замедлять реакцию. Это связано с тем, что при повышении температуры некоторые реакционные частицы обладают такой высокой энергией, что выходят за пределы активной зоны реакции. Также возможно разложение реагентов при высоких температурах, что может привести к снижению концентрации реакционных частиц и уменьшению скорости реакции.
Температура также влияет на равновесие химической системы. По принципу Ле Шателье при повышении температуры равновесие сдвигается в ту сторону, на которой эндотермическая реакция происходит с поглощением тепла. В то же время, реакция, сопровождающаяся выделением тепла (экзотермическая), будет сдвигаться в обратном направлении при повышении температуры.
Таким образом, температура играет важную роль в протекании химических реакций. Она может влиять на скорость реакции, направление ее протекания и состав реакционной смеси. Понимание этого фактора является ключевым для контроля и оптимизации химических процессов.
Давление и химические реакции
Во-первых, давление может оказывать влияние на газообразные реакции. При увеличении давления, протекающие реакции с газообразными веществами могут происходить быстрее. Это объясняется тем, что увеличение давления приводит к увеличению частоты столкновений молекул реагентов, что повышает вероятность их взаимодействия и реакции.
Во-вторых, давление может влиять на изобретение или разрыв химических связей. При высоком давлении, связи между атомами или молекулами могут сломаться или образоваться новые связи. Это может стимулировать химические реакции и изменить состав реагентов и продуктов.
Можно отметить, что давление также может быть важным при проектировании и оптимизации промышленных химических процессов. Управление давлением может помочь ускорить реакции или повысить выход продукта. Однако, повышение давления может также повлечь за собой дополнительные требования для оборудования и повышение затрат.
В целом, понимание и управление давлением является важным аспектом в химической кинетике и технологии производства. Это позволяет контролировать скорость и эффективность реакций, что является ключевым фактором для достижения желаемых результатов в химической промышленности и научных исследованиях.
Концентрация и химические реакции
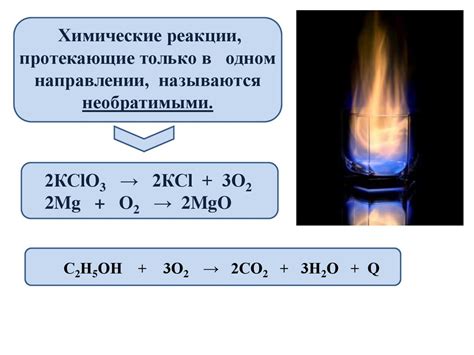
Концентрация вещества влияет на скорость химической реакции. Повышение концентрации обычно приводит к увеличению скорости реакции. Это объясняется тем, что более высокая концентрация означает большее количество вещества, доступного для взаимодействия, и большую вероятность столкновений между молекулами реагирующих веществ.
Изменение концентрации одного из реагентов может также повлиять на полноту и направление реакции. Если концентрация одного из реагентов возрастает или уменьшается, то это может сместить равновесие реакции в сторону образования или потребления этого реагента, в зависимости от характера реакции.
Например, при реакции образования газа, увеличение концентрации одного из реагентов может способствовать образованию большего количества газового вещества. Частные случаи таких реакций - образование пузырьков в основании стакана с газировкой или пена в результате смешения мыла и воды.
Таким образом, понимание концентрации и ее влияния на протекание химических реакций позволяет нам лучше понять и контролировать процессы, происходящие в мире химии и веществах вокруг нас.
Катализаторы и химические реакции
Катализаторы действуют, участвуя в реакции, но в конце процесса возвращаются к исходному состоянию и могут быть использованы вновь. Они не расходуются и могут быть использованы в течение продолжительного времени.
Как правило, катализаторы могут изменить скорость протекания реакции без изменения ее общей энергии активации или изменения продуктов реакции. Они влияют на скорость разрыва или формирования связей между молекулами веществ, принимающих участие в реакции.
Некоторые катализаторы могут быть специфичными и применяться только в определенных типах реакций, в то время как другие могут быть более универсальными и использоваться в различных химических процессах.
Катализаторы играют важную роль в промышленности, позволяя снизить затраты на энергию, улучшить эффективность процессов и сократить выделение вредных продуктов реакции.
| Преимущества использования катализаторов |
|---|
| Увеличение скорости реакции |
| Снижение температуры и давления реакции |
| Экономия энергии |
| Уменьшение выделения вредных веществ |
| Возможность использования низкосортных сырьевых материалов |
Кроме положительных аспектов, катализаторы могут иметь и некоторые недостатки. Они могут быть чувствительны к температуре и давлению, их использование может требовать дополнительных реагентов или специфических условий. Кроме того, некоторые катализаторы могут быть ядовитыми или вызывать нежелательные побочные реакции.
В целом, катализаторы являются важными инструментами в химических реакциях, которые позволяют оптимизировать процессы, снижать затраты и улучшать эффективность производства.
Свет и химические реакции

Свет играет важную роль в процессе протекания химических реакций. Отображение света на химические процессы может быть различным в зависимости от типа реакции и условий, в которых она происходит.
Один из способов использования света в химических реакциях - это фотосинтез, процесс, при котором растения преобразуют энергию света в химическую энергию для синтеза органических веществ. Фотосинтез позволяет растениям получать необходимые для их жизнедеятельности вещества и осуществлять продуцирование кислорода.
Кроме того, свет может использоваться в качестве активатора химических реакций. Некоторые реакции происходят только при наличии света определенной длины волны. Например, фотолиз воды - реакция распада воды на кислород и водород - требует наличия света с энергией, достаточной для активации данного процесса.
Освещение также может влиять на скорость протекания химических реакций. Иногда реакции происходят быстрее или медленнее при наличии искусственного или естественного света. Это объясняется тем, что свет может изменять конформацию молекул, активировать реакционным партнерам, а также ускорять или замедлять процессы переноса электронов.
Таким образом, свет оказывает значительное влияние на химические реакции, играя роль активатора, регулятора и изменяя скорость протекания процессов в зависимости от его характеристик и условий, в которых он применяется.
Растворители и химические реакции
Влияние растворителей на химические реакции может быть связано со следующими факторами:
| Фактор | Влияние |
|---|---|
| Растворимость реагентов | Растворитель может повышать или понижать растворимость реагентов, что влияет на их взаимодействие и скорость реакции. |
| Диссоциация реагентов | Растворитель может способствовать диссоциации реагентов на ионы, что ускоряет химическую реакцию. |
| Реакционное равновесие | Растворитель может смещать равновесие химической реакции в одну или другую сторону. |
| Реакционный механизм | Растворитель может изменять реакционный механизм, влияя на скорость и характер продуктов реакции. |
Выбор растворителя является важным аспектом при проектировании и проведении химических реакций. Он может определять успешность реакции и качество получаемых продуктов.
Изучение влияния растворителей на химические реакции позволяет улучшать процессы синтеза, оптимизировать условия реакции и получать более высокие выходы целевых продуктов.
Электролиты и химические реакции

В химических реакциях электролиты могут быть как реагентами, так и продуктами. Например, в реакции между кислотой и щелочью электролиты используются в качестве реагентов. Кислота и щелочь диссоциируют в растворе на ионы водорода (H+) и гидроксид-ионы (OH-), соответственно. Эти ионы взаимодействуют между собой, образуя воду и соль. В результате реакции образуются новые вещества - вода и соль, которые являются электролитами.
Другим примером химической реакции, в которой участвуют электролиты, является электролиз. При электролизе электрический ток прогоняется через раствор электролита или расплавленное вещество. В процессе электролиза происходит распад электролита на ионы. Анодом является положительно заряженный электрод, на котором происходит окисление, а катодом - отрицательно заряженный электрод, где происходит восстановление. Электролиты могут играть роль как растворенных веществ, так и веществ, расплавленных при высокой температуре. В данном процессе реагенты, образующие ионы, претерпевают химические реакции на электродах, и образуются новые вещества.
Таблица ниже иллюстрирует примеры электролитов и типы реакций, в которых они принимают участие.
| Тип реакции | Пример электролитов |
|---|---|
| Кислотно-щелочная реакция | Соляная кислота (HCl), калий гидроксид (KOH) |
| Окислительно-восстановительная реакция | Перманганат калия (KMnO4), гидрохлорид железа (FeCl3) |
| Электролиз | Кислотные растворы (H2SO4), расплавы солей (NaCl) |
Таким образом, электролиты играют важную роль в условиях протекания химических реакций. Они обладают способностью образовывать ионы, которые могут взаимодействовать с другими веществами и протекать химические реакции. Понимание роли электролитов помогает объяснить и предсказать протекание различных химических процессов.








