Электролитическая диссоциация - это процесс, при котором ионная соединения растворяются в воде и разделяются на положительно и отрицательно заряженные ионы. Степень электролитической диссоциации (или процент ионизации) определяет, насколько полный этот процесс в растворе. Если степень диссоциации равна 98, это означает, что 98% ионов освобождается в растворе, а только 2% остается в недиссоциированной форме.
Степень электролитической диссоциации имеет важное значение для химических реакций, так как она определяет число доступных реагентов. Чем выше степень диссоциации, тем больше ионов доступно для реакций, и тем быстрее протекает химическая реакция. В случае, когда степень диссоциации равна 98%, это означает, что практически все молекулы электролита разделяются на ионы, что существенно увеличивает скорость химической реакции.
Высокая степень электролитической диссоциации также может улучшить проводимость раствора, что полезно для электролитов, используемых в электролитических устройствах, таких как аккумуляторы и топливные элементы. Это обусловлено тем, что большое количество ионов в растворе способно передавать электрический заряд.
Однако стоит отметить, что степень электролитической диссоциации зависит не только от свойств раствора, но и от химической природы реагентов. Некоторые реагенты могут иметь меньшую степень диссоциации, даже в условиях, когда она в принципе может быть высока. Это связано с их внутренним строением и межмолекулярными взаимодействиями.
Влияние степени электролитической диссоциации на реакцию
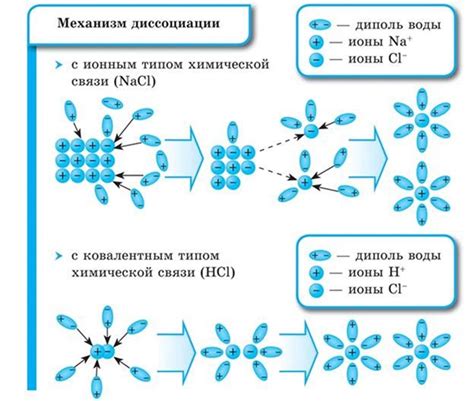
Степень электролитической диссоциации определяет, в какой мере электролит разделяется на ионы при растворении в воде. Если степень диссоциации равна 98%, это означает, что практически все молекулы электролита разделяются на ионы.
Влияние степени электролитической диссоциации на реакцию может быть значительным. При большой степени диссоциации реакции с участием электролита могут протекать более интенсивно, поскольку больше ионов доступно для реагирования. Это может ускорять химическую реакцию и повышать скорость образования продуктов.
Кроме того, степень электролитической диссоциации может влиять на равновесие химической реакции. При высокой степени диссоциации, концентрация ионов будет выше, что может сдвигать равновесие реакции в сторону образования продуктов. Если степень диссоциации низкая, то концентрация ионов будет меньше, что может сдвигать равновесие реакции в сторону образования реагентов.
Таким образом, степень электролитической диссоциации играет важную роль в химических реакциях. Ее значительное значение может ускорять процессы реакции и изменять равновесие.
Что такое степень электролитической диссоциации
Степень электролитической диссоциации обозначается символом α и выражается в процентах или в виде десятичной дроби от 0 до 1. Например, если степень диссоциации равна 0.98, это означает, что 98% электролита диссоциировало на ионы в растворе.
Степень электролитической диссоциации зависит от различных факторов, таких как концентрация электролита, температура, растворитель и наличие других веществ в растворе. Чем выше степень диссоциации, тем более ионизированным является раствор и тем больше свободных ионов носителя заряда присутствует в нем.
Степень электролитической диссоциации играет важную роль в реакциях химического взаимодействия. Высокая степень диссоциации электролита означает, что большая часть его молекул переходит в ионы, что способствует эффективности реакции. Низкая степень диссоциации, напротив, может замедлить химическую реакцию или снизить ее эффективность.
Почему степень электролитической диссоциации важна
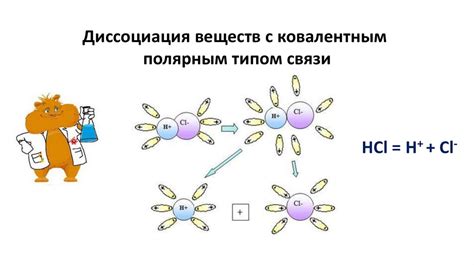
Степень электролитической диссоциации может иметь влияние на характер процесса реакции. Полностью диссоциированные электролиты легко участвуют в химических реакциях и образуют больше продуктов реакции. С другой стороны, недостаточно диссоциированные электролиты могут образовывать меньше продуктов реакции и быть менее реакционноспособными.
Зная степень электролитической диссоциации, мы можем предсказать характер реакции и влияние различных факторов, таких как температура, концентрация реагентов или добавление катализатора. Высокая степень диссоциации может указывать на высокое химическое активность вещества, в то время как низкая степень диссоциации может указывать на малую реакционную способность.
Кроме того, степень электролитической диссоциации играет важную роль в расчетах химических равновесий, компоновки растворов и определении концентрации ионов в растворе. Он также влияет на проводимость электролитов и может быть использован для оценки качества и стабильности вещества.
В итоге, зная степень электролитической диссоциации, мы можем лучше понять и контролировать химические процессы, что является важным для различных областей науки и промышленности.
Как определить степень электролитической диссоциации
Для определения степени электролитической диссоциации можно использовать различные методы, в зависимости от типа реакции и химического соединения. Одним из таких методов является проведение эксперимента по электролизу раствора.
Для проведения эксперимента потребуется электролитическая ячейка, состоящая из двух электродов – анода и катода – и электролитического раствора, содержащего исследуемое вещество. Анод представляет собой положительно заряженный электрод, катод – отрицательно заряженный.
Затем необходимо приложить постоянное напряжение к электродам. При этом ионы вещества будут перемещаться к электродам, где будут происходить реакции окисления и восстановления. Результатом реакции будет образование видимых или невидимых продуктов.
| Вид продукта | Степень электролитической диссоциации |
|---|---|
| Образование газа | Высокая |
| Образование осадка | Низкая |
| Изменение окраски раствора | Средняя |
| Отсутствие видимых изменений | Отсутствие диссоциации |
Таким образом, исследуя видимые результаты электролиза раствора, можно определить степень электролитической диссоциации. Это позволяет более точно оценить характер реакции и способность вещества образовывать ионы в растворе.








