Атом - это минимальная единица вещества, которая обладает химическими свойствами элемента. В составе атома содержатся три основных частицы - протоны, нейтроны и электроны. Строение атома основано на принципе электростатического притяжения и взаимодействия между этими частицами.
Протоны - это положительно заряженные частицы, которые находятся в центре атома, в ядре. Количество протонов в атоме определяет его атомный номер и определяет, к какому элементу он относится. Масса протона приблизительно равна массе нейтрона.
Нейтроны - это нейтрально заряженные частицы, также находящиеся в ядре атома. Их количество может варьироваться в атомах одного элемента, поэтому атомы одного элемента могут иметь различные массовые числа, но одинаковое атомное число.
Электроны - это отрицательно заряженные частицы, которые обращаются по орбитам вокруг ядра. Электроны находятся на разных уровнях энергии и наполняют энергетические оболочки атома. Их количество также может меняться, и это определяет химические свойства атома.
Таким образом, атом состоит из протонов и нейтронов в ядре, а электроны движутся вокруг него в энергетических оболочках. Взаимодействие этих частиц определяет физические и химические свойства атомов и элементов, и, таким образом, позволяет нам понять и объяснить различные явления в химии и физике.
Состав атома элемента и его частицы
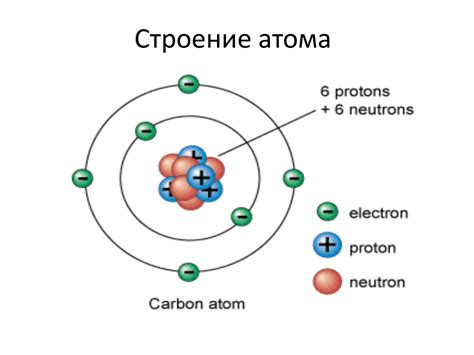
- Протоны – это положительно заряженные частицы, обеспечивающие массу атомного ядра. Они имеют массовое число 1 и заряд +1.
- Нейтроны не имеют электрического заряда и являются нейтральными частицами. Они вместе с протонами образуют атомное ядро и имеют массовое число 1.
- Электроны находятся вокруг ядра и обладают отрицательным электрическим зарядом. Они имеют массовое число 0 и заряд -1.
Протоны и нейтроны образуют ядро атома, которое содержит почти всю массу атома, а электроны находятся на разных энергетических уровнях вокруг ядра.
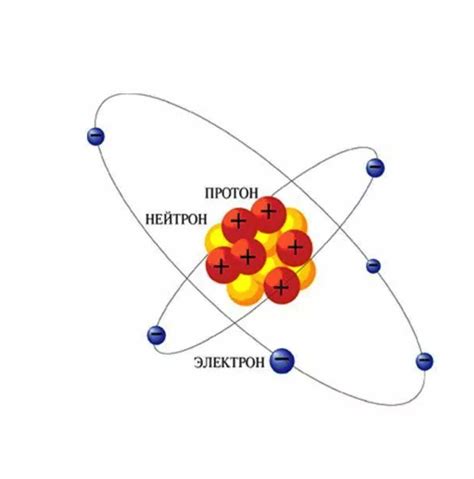
Протоны, нейтроны и электроны - основные компоненты атома
Протоны - это положительно заряженные частицы, находящиеся в ядре атома. У каждого протона есть масса, равная единице атомной массы, и положительный электрический заряд. Количество протонов в атоме определяет его атомный номер и определяет его химические свойства.
Нейтроны - это нейтральные частицы, также находящиеся в ядре атома. У нейтронов нет электрического заряда, и их масса также равна единице атомной массы. Количество нейтронов в атоме может варьироваться, что приводит к образованию изотопов.
Электроны - это отрицательно заряженные частицы, которые движутся по орбитам вокруг ядра атома. Они имеют крайне малую массу, поэтому их массой пренебрегают при вычислениях. Количество электронов в атоме равно количеству протонов, что делает атом электрически нейтральным.
Протоны, нейтроны и электроны взаимодействуют между собой, создавая стабильную структуру атома. Протоны и нейтроны находятся в ядре атома, а электроны движутся вокруг ядра по определенным орбитам.
Изучение состава атома и его компонентов помогает нам понять основные принципы химии и ядерной физики, а также использовать этот знак для разработки новых материалов и технологий.
Протоны - положительно заряженные частицы в ядре атома
Каждый протон имеет положительный электрический заряд, который равен элементарному заряду и составляет единицу положительного заряда. Обозначение элементарного положительного заряда - "е". Таким образом, заряд протона равен +е.
Масса протона составляет примерно 1,67 х 10^-27 килограмма, что примерно в 1836 раз больше массы электрона - другой элементарной частицы атома.
Протоны в ядре атома не только обладают положительным зарядом, но также они взаимодействуют с нейтронами через сильное ядерное взаимодействие. Вместе с нейтронами они образуют ядро атома, которое содержит основную массу массы всего атома.
Количество протонов в ядре определяет химический элемент. Например, свободный атом водорода содержит один протон в ядре, а атом гелия содержит два протона в ядре. Изменение количества протонов в ядре определяет изменение химического элемента, что приводит к образованию разных веществ и соединений.
Протоны также играют ключевую роль во многих ядерных реакциях и процессах, таких как фиссия и синтез атомных ядер. Их заряд и масса существенно влияют на электромагнитные и химические свойства атомов и их взаимодействия.
Нейтроны - нейтральные частицы в ядре атома
Нейтроны обладают массой, сравнимой с массой протона, и считаются стабильными частицами. Это значит, что они не распадаются со временем и остаются внутри ядра атома.
Нейтроны выполняют несколько важных функций в атоме. Во-первых, они помогают протонам удерживаться в ядре благодаря сильным ядерным силам. Во-вторых, они отвечают за стабильность ядра и предотвращают его распад.
В то время как протоны имеют положительный заряд и отталкивают друг друга из-за электростатического отталкивания, нейтроны, будучи нейтральными, не взаимодействуют между собой электрическим образом.
Нейтроны также играют важную роль в реакциях деления и синтеза ядер, где они могут быть абсорбированы или испускаться. Они позволяют атомным реакторам работать и являются ключевым компонентом ядерной энергии.
Электроны - отрицательно заряженные частицы, движущиеся вокруг ядра
Электроны движутся по орбитам вокруг ядра атома. Ядро состоит из протонов и нейтронов, и оно обладает положительным зарядом. В то время как ядро сосредоточено в центре атома, электроны находятся в областях, называемых электронными оболочками. Количество электронов в атоме равно количеству протонов, что обеспечивает электрическую нейтральность атома.
Электроны могут изменять свою энергию, переходя с одной орбиты на другую. Это происходит при поглощении или испускании фотонов, которые являются квантами энергии света. Энергетические уровни электронов характеризуются различными электронными оболочками и подобно "лестнице" с разными уровнями ступеней.
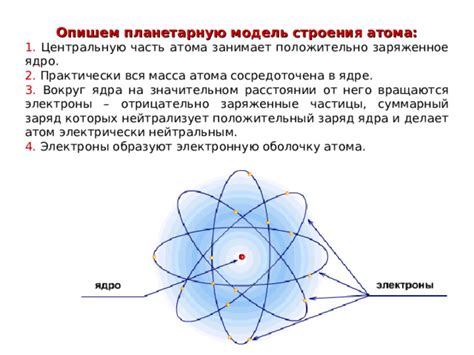
Ядро атома - центральная часть, содержащая протоны и нейтроны
В качестве символа протона часто используется буква p, а нейтрона - n. Ядро атома можно обозначить с помощью химического символа элемента, за которым указывается суммарное количество протонов и нейтронов. Например, для атома углерода суммарное количество протонов и нейтронов составляет 12, поэтому его ядро можно обозначить как С-12.
Протоны и нейтроны являются нуклонами, которые находятся в непосредственной близости друг от друга. Взаимодействие между ними осуществляется с помощью сильного ядерного взаимодействия, которое обладает очень большой силой. Это позволяет ядру быть стабильным и удерживать протоны и нейтроны вместе.
Масса ядра определяется преимущественно массой протонов и нейтронов. Она значительно превышает массу электронной оболочки, состоящей из электронов. Поэтому ядро атома сосредоточено в его небольшом объеме и имеет высокую плотность.
Ядро атома играет ключевую роль в его структуре и характеристиках. Изменение числа протонов и нейтронов в ядре приводит к образованию атомов различных элементов и изменению их химических свойств.
Электронные облака - области, где находятся электроны
Электроны являются одной из основных частиц, образующих атомы. Они заряжены отрицательно и находятся вокруг ядра в электронных облаках. В атоме может быть несколько электронных облаков, которые могут иметь различные формы и размеры.
Электроны находятся в постоянном движении и образуют электронные оболочки. Электронные оболочки можно представить как "слои" или "уровни", на которых находятся электроны.
Наиболее близкие к ядру оболочки содержат меньшее количество электронов, а более удаленные оболочки - большее количество электронов. Это связано с энергией электронов и их взаимодействием с ядром.
Электронные облака имеют определенные энергетические уровни, которые называются квантовыми оболочками. Каждый энергетический уровень может содержать определенное число электронов.
Переходы электронов между различными энергетическими уровнями приводят к испусканию или поглощению энергии в виде света или других электромагнитных волн. Это феномен, который наблюдается, например, при излучении света флуоресцентных или люминесцентных веществ.
Энергетические уровни - разделение электронов по энергии
Атом состоит из ядра, в котором находятся протоны и нейтроны, а также электронной оболочки, на которой располагаются электроны. Электроны обладают отрицательным зарядом и окружают ядро на различных энергетических уровнях.
Энергетические уровни в атоме разделены по энергии. Ближайший к ядру уровень имеет наименьшую энергию и называется основным. Каждый следующий уровень имеет большую энергию.
На каждом энергетическом уровне могут находиться определенное количество электронов. Максимальное количество электронов на уровне можно определить по формуле 2n^2, где n - номер энергетического уровня.
Основной уровень (n=1) содержит максимально 2 электрона. Уровень n=2 может вместить до 8 электронов, уровень n=3 - до 18 электронов и так далее. Если все уровни заполнены, электроны могут переходить на более высокие энергетические уровни при нагревании или поглощении энергии.
Переход электрона с одного уровня на другой происходит при поглощении или излучении энергии. При переходе электрона на более высокий уровень энергия атома увеличивается, а при переходе на более низкий - уменьшается.
Внешняя электронная оболочка - область с наибольшим энергетическим уровнем
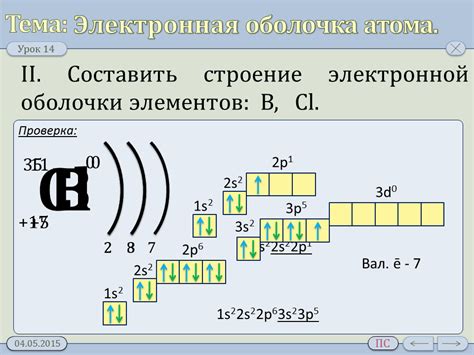
Внешняя электронная оболочка играет важную роль в химических свойствах атомов. Именно количество электронов в этой оболочке определяет валентность атома и его способность взаимодействовать с другими атомами. Атомы стремятся достичь электронной конфигурации инертных газов, обладающих полностью заполненной внешней оболочкой.
Таблица Менделеева позволяет определить количество электронов на внешней оболочке для каждого химического элемента. Эта информация позволяет предсказывать химические свойства элементов и их взаимодействие в химических реакциях.
Внешняя электронная оболочка может иметь различное количество электронов, например, водород имеет всего один электрон на внешней оболочке, кислород – шесть, а йод – семь. Это различное количество электронов на внешней оболочке объясняет различие в химических свойствах этих элементов.
| Элемент | Атомный номер | Электронная конфигурация | Количество электронов на внешней оболочке |
|---|---|---|---|
| Водород | 1 | 1s1 | 1 |
| Кислород | 8 | 1s2 2s2 2p4 | 6 |
| Йод | 53 | [Kr] 5s2 4d10 5p5 | 7 |
Электроны на внешней электронной оболочке могут участвовать в химической реакции при образовании или разрыве химических связей с электронами других атомов. Это позволяет атомам формировать молекулы и соединения различной сложности.
Внешняя электронная оболочка также определяет электронную аффинность и электронегативность элементов. Атомы с полностью заполненными внешними оболочками имеют малую электронную аффинность и низкую электронегативность, в то время как элементы с не полностью заполненной внешней оболочкой имеют большую электронную аффинность и высокую электронегативность.
Массовое число - общее количество протонов и нейтронов в ядре
Протоны и нейтроны называются нуклонами и являются основными составляющими частями атомного ядра. Протоны имеют положительный электрический заряд, а нейтроны не имеют заряда. Общее количество нуклонов в ядре определяет его массовое число.
Массовое число является целым числом и определяет массу атома в атомных массовых единицах (аму). Оно приближенно равно числу нуклонов в ядре, так как масса электронов, находящихся в оболочке атома, пренебрежимо мала по сравнению с массой протонов и нейтронов.
Изменение массового числа может происходить при ядерных реакциях, таких как расщепление ядра или синтез нового ядра. При этом число протонов может измениться, что приведет к образованию нового элемента, а число нейтронов может измениться, что приведет к образованию изотопа.
Массовое число является важным параметром в химии и физике атома, так как оно влияет на его свойства и поведение. Поэтому, понимание и изучение массового числа позволяет лучше понять структуру и разнообразие атомов различных элементов.
Атомное число - количество протонов в ядре элемента
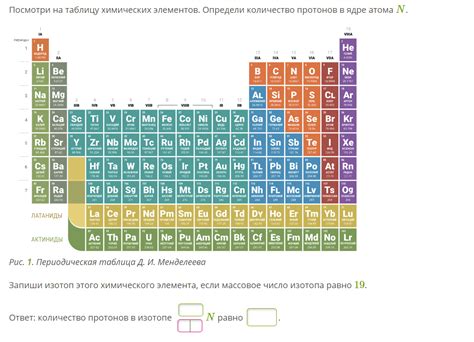
Протоны, составляющие ядро атома, имеют положительный заряд. Именно их количество и определяет атомное число элемента. Например, у водорода атомное число равно 1, так как в ядре находится один протон. Углерода атомное число равно 6, так как в ядре содержится шесть протонов.
Атомное число также определяет количество электронов в нейтральном атоме элемента. В нейтральном атоме количество электронов равно количеству протонов, то есть атомному числу. Однако в ионизированном состоянии атом может иметь разное количество электронов в зависимости от ионного заряда.
Знание атомного числа позволяет определить положение элемента в периодической системе, его родство с другими элементами и предсказать его химические свойства. Атомное число является важным параметром при изучении элементов и их взаимодействия в химических реакциях.








