Сильный электролит - это вещество, которое при растворении в воде полностью диссоциирует на ионы. Такие вещества обладают высокой электропроводностью и являются хорошими проводниками электрического тока.
Основные свойства сильных электролитов включают их способность образовывать ионы в растворе, обладать высокой электропроводностью, проводить ток только в растворе и расщепляться на ионы только в присутствии воды.
Сильные электролиты могут быть классифицированы на два основных типа: кислоты и соли.
Кислоты - это сильные электролиты, которые при диссоциации образуют в растворе положительные и отрицательные ионы водорода (H+) и отрицательные ионы кислотного остатка. Примерами кислот являются соляная кислота (HCl), серная кислота (H2SO4) и уксусная кислота (CH3COOH).
Соли - это сильные электролиты, которые при диссоциации образуют в растворе положительные и отрицательные ионы, не связанные с водородом. Примерами солей являются нитрат натрия (NaNO3), хлорид калия (KCl) и сульфат магния (MgSO4).
Что такое электролит?

Ионы являются носителями электрического заряда и могут перемещаться под воздействием электрического поля. Это позволяет электролиту проводить электрический ток. В растворе электролит может состоять из катионов – положительно заряженных ионов, и анионов – отрицательно заряженных ионов.
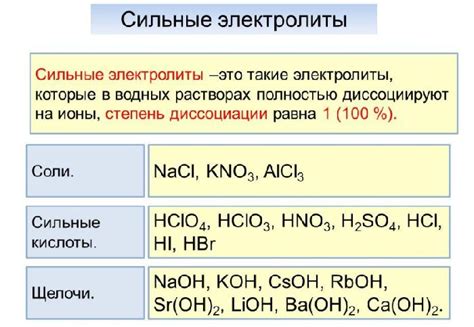
В зависимости от степени диссоциации электролиты делятся на сильные и слабые. Сильные электролиты полностью диссоциируют в растворе, образуя ионы. Например, соляная кислота (HCl) и хлорид натрия (NaCl) являются сильными электролитами.
Наиболее распространенными типами электролитов являются соли, кислоты и щелочи. Соли образуются при диссоциации металлических ионов с кислотными или щелочными ионами. Кислоты диссоциируют на водородные иони (протоны) и щелочи – на гидроксидные иони.
| Тип электролита | Примеры |
|---|---|
| Соли | Хлорид натрия (NaCl), сульфат магния (MgSO4), карбонат кальция (CaCO3) |
| Кислоты | Соляная кислота (HCl), азотная кислота (HNO3), серная кислота (H2SO4) |
| Щелочи | Гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH) |
Электролиты имеют широкий спектр применения в различных областях, таких как химия, биология, медицина и технология. Их свойства и поведение изучают в рамках электрохимии, где они играют важную роль.
Определение сильного электролита
Сильные электролиты могут быть представлены различными классами соединений, такими как кислоты, щелочи и соли. Например, соляная кислота (HCl), серная кислота (H2SO4), гидроксид натрия (NaOH) - все они являются примерами сильных электролитов. Важно отметить, что степень диссоциации сильного электролита может быть разной. Например, некоторые сильные кислоты, такие как соляная кислота, обладают высокой степенью диссоциации, тогда как другие могут быть меньше или равны 100%.
Сильные электролиты играют важную роль во многих химических процессах и являются фундаментальными для понимания химии растворов и электролитической проводимости. Их свойства и поведение могут быть изучены и использованы в различных областях, таких как аналитическая химия, фармацевтика, биология и электрохимия.
Свойства сильного электролита
Сильный электролит обладает рядом особых свойств, которые отличают его от слабых электролитов и незаряженных веществ:
- Сильный электролит полностью диссоциирует в растворе, что означает, что все его молекулы распадаются на ионы. Например, соляная кислота (HCl) в водном растворе диссоциирует на ионы водорода (H+) и хлорида (Cl-).
- Сильный электролит обладает высокой электропроводностью, так как раствор содержит большое количество свободных ионов. Это делает его хорошим проводником электричества.
- Сильный электролит имеет высокую реактивность и может вызывать сильные химические реакции с другими веществами. Например, серная кислота (H2SO4) сильно реагирует с основаниями, образуя соль и воду.
Сильные электролиты обычно имеют ярко выраженные кислотные или щелочные свойства и могут быть использованы в различных отраслях науки и промышленности.
Роль сильного электролита в химии
Сильный электролит играет важную роль в химии, поскольку он способен полностью ионизироваться в растворе, образуя ионы. Это свойство делает его ценным инструментом для проведения различных химических реакций и исследований.
Во-первых, сильные электролиты используются в качестве электролитов в электрохимических ячейках и батареях. Ионы сильных электролитов эффективно перемещаются между полюсами, обеспечивая поток электрического заряда. Это позволяет химическим реакциям протекать внутри ячейки или батареи и, таким образом, генерировать электричество.
Во-вторых, сильные электролиты применяются в аналитической химии для проведения различных химических реакций и определения концентрации различных веществ. Например, с помощью сильных электролитов можно провести титрование - метод определения концентрации определенного вещества в растворе, основанный на реакции между реагентами.
Кроме того, сильные электролиты используются в процессах электроосаждения и гальванического покрытия. При электроосаждении ионы сильных электролитов превращаются в элементарные составляющие и осаждается на поверхности металлического предмета, образуя защитное и декоративное покрытие.
Все эти примеры подчеркивают важность сильных электролитов в химии и их широкий спектр применения. Роль сильных электролитов не ограничивается только этими областями, и они продолжают исследоваться и применяться во многих других сферах химии и науки в целом.
Основные виды сильных электролитов
Сильные электролиты могут быть представлены в различных формах. Некоторые из основных видов сильных электролитов включают:
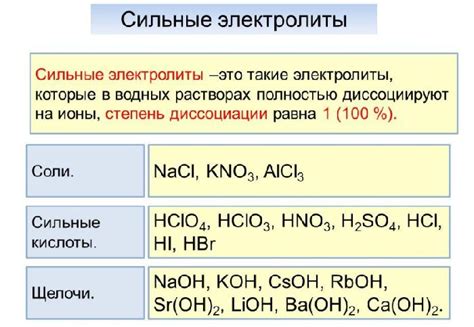
Сильные кислоты: такие кислоты, как соляная кислота (HCl), серная кислота (H2SO4) и азотная кислота (HNO3), считаются сильными электролитами, так как они полностью или практически полностью диссоциируют в растворе, образуя ионы водорода (H+) и анионы.
Сильные основания: натриевая гидроксид (NaOH), калиевая гидроксид (KOH) и гидроксид аммония (NH4OH) являются примерами сильных оснований. Они также полностью или практически полностью диссоциируют в растворе, образуя катионы и анионы.
Сильные соли: соли, образованные из сильных кислот и сильных оснований, считаются сильными электролитами. Например, хлорид натрия (NaCl), сульфат меди (II) (CuSO4) и нитрат калия (KNO3) являются сильными электролитами.
Выпадающие осадки: некоторые вещества могут образовывать нерастворимые осадки, которые не диссоциируют в растворе. Это включает соли некоторых металлов, таких как карбонаты, фосфаты и гидроксиды. Например, гидроксид алюминия (Al(OH)3) и серебро хлорид (AgCl) являются примерами осадков.
Сильные электролиты играют важную роль не только в химических реакциях, но и в множестве приложений, включая использование в батареях, электролитических процессах и многих других областях.
Примеры сильных электролитов
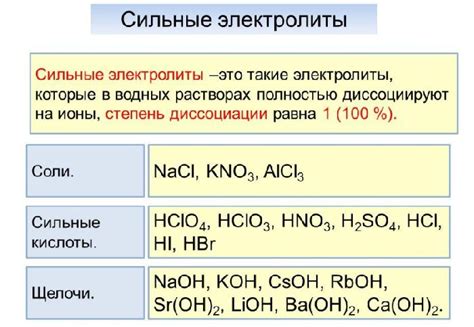
Примеры сильных электролитов включают:
- Соляная кислота - HCl
- Серная кислота - H2SO4
- Азотная кислота - HNO3
- Щавелевая кислота - C2H2O4
- Гидрохлорид аммония - NH4Cl
- Гидроксид натрия - NaOH
- Гидроксид калия - KOH
- Хлорид железа(III) - FeCl3
- Сульфат натрия - Na2SO4
- Нитрат аммония - NH4NO3
Эти вещества полностью ионизируются в водном растворе, образуя ионы. Сильные электролиты обычно характеризуются высокой проводимостью электрического тока.
Как определить сильный электролит?
Сильный электролит обладает способностью полностью ионизироваться в водном растворе, разделяясь на положительные и отрицательные ионы. Для определения сильного электролита можно использовать несколько методов:
| Метод | Описание |
|---|---|
| Электропроводность | Сильные электролиты отличаются высокой электропроводностью в водном растворе. Можно измерить проводимость раствора с помощью электропроводимостных приборов, таких как кондуктометр. |
| Ионный характер | Сильные электролиты образуют ионы, которые легко реагируют с другими веществами. При добавлении сильного электролита к раствору другого вещества, происходит образование осадка или сильные химические реакции. |
| Распад вещества | Сильные электролиты полностью распадаются на ионы в водном растворе, в отличие от слабых электролитов, которые распадаются только частично. Можно определить сильный электролит по его способности полного ионизирования. |
Используя эти методы, можно определить, является ли вещество сильным электролитом или нет. Понимание, какие вещества являются сильными электролитами, важно при проведении химических реакций и изучении свойств различных растворов.








