Основания и кислоты - две важные группы химических веществ, которые играют значительную роль во многих процессах. Они взаимодействуют с другими веществами, проявляя свою активность. Но кто из них более активен, кислоты или основания?
Сильные кислоты, такие как серная или хлороводородная кислоты, обладают высокой активностью. Они способны быстро отдавать H+ и образовывать соответствующие анионы. Благодаря своей активности, они могут вызывать ожоги, корродировать металлы и оказывать разрушительное воздействие на другие вещества.
Сильные основания, такие как гидроксид натрия или гидроксид калия, тоже обладают высокой активностью. Они способны быстро принимать H+ и образовывать соответствующие катионы. Сильные основания также могут вызывать ожоги и разрушить некоторые материалы.
Таким образом, оба типа химических веществ - сильные кислоты и сильные основания - являются активными и способны оказывать разрушительное воздействие на окружающую среду и другие вещества. Важно быть осторожным при работе с ними и соблюдать все меры безопасности.
Сильные основания: свойства и реакции
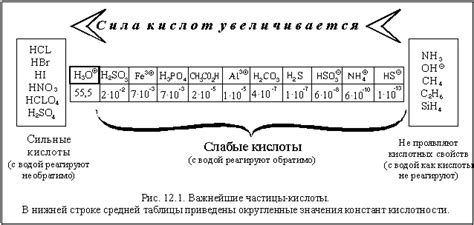
Вот некоторые свойства сильных оснований:
- Сильные основания растворяются в воде и образуют гидроксидные ионы (OH-).
- Сильные основания обладают высокой способностью принимать протоны от кислот.
- Сильные основания имеют высокую щелочность и могут вызывать ощущение жгучей щелочи на коже и слизистых оболочках.
Реакции сильных оснований могут происходить с различными веществами:
- Сильные основания образуют нерастворимые осадки при взаимодействии с некоторыми металлами, например, алюминием (Al) или железом (Fe).
- Сильные основания также могут реагировать с кислотами, образуя соли и воду. Например, при взаимодействии с соляной кислотой (HCl) образуется хлорид натрия (NaCl) и вода (H2O).
- Сильные основания реагируют с кислотными оксидами, образуя соли. Например, при взаимодействии с углекислым газом (CO2) образуется карбонат натрия (Na2CO3).
Важно отметить, что сильные основания обладают сильной реакционной способностью и могут вызывать опасность при неправильном использовании или недостаточной осторожности.
Сильные щелочные растворы и их активность
Гидроксидные ионы в щелочных растворах имеют способность образовывать кислородно-связанные анионы, что способствует их активности. Сильные щелочные растворы обычно содержат щелочные металлы, такие как натрий (NaOH), калий (KOH) или гидроксид кальция (Ca(OH)2), которые обеспечивают высокую активность раствора.
Взаимодействуя с кислотами, щелочные растворы реагируют с их протононосителями и образуют соли и воду. Данная реакция называется нейтрализацией и является одной из наиболее характерных химических реакций щелочных растворов.
Для определения активности щелочных растворов используется показатель pH. Сильные щелочные растворы имеют высокий показатель pH, обычно от 12 до 14. Чем выше концентрация гидроксидных ионов, тем выше показатель pH и активность раствора.
Одной из особенностей щелочных растворов является их жесткость, которая определяет их способность растворять различные вещества. Сильные щелочные растворы могут растворять органические и неорганические соединения, а также высокомолекулярные вещества.
| Щелочь | Формула | Реакция с кислотой |
|---|---|---|
| Натрий гидроксид | NaOH | NaOH + HCl → NaCl + H2O |
| Калий гидроксид | KOH | KOH + HNO3 → KNO3 + H2O |
| Гидроксид кальция | Ca(OH)2 | Ca(OH)2 + H2SO4 → CaSO4 + 2H2O |
Сильные щелочные растворы находят широкое применение в различных отраслях науки и промышленности. Они используются в лабораториях для проведения химических анализов, в бытовых целях для очистки и дезинфекции, а также в производстве различных химических веществ и материалов.
Механизмы диссоциации сильных оснований
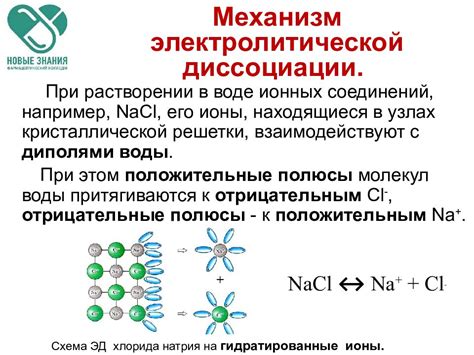
Диссоциация сильных оснований происходит по механизму ионного разрушения. Когда сильное основание попадает в водный раствор, оно реагирует с водой, образуя ионы гидроксида (OH-). Процесс диссоциации сильных оснований полностью протекает, и все основание переходит в ионы.
Для примера рассмотрим диссоциацию сильного основания – гидроксида натрия (NaOH). Когда гидроксид натрия попадает в воду, он реагирует с водой по следующему уравнению:
NaOH + H2O -> Na+ + OH-
В результате реакции в растворе образуются ионы натрия (Na+) и ионы гидроксида (OH-). Эти ионы полностью разделены и свободно движутся в растворе. Гидроксид натрия является сильным основанием, поэтому весь гидроксид натрия диссоциирует, и в растворе образуется большое количество ионов гидроксида.
Диссоциация сильных оснований происходит полностью, поэтому реакция основания с водой считается протекающей в одну сторону. Это отличает сильные основания от слабых, которые диссоциируют только частично.
Механизм диссоциации сильных оснований основан на постоянной передаче протона от воды к основанию. Водные растворы сильных оснований обладают высокой щелочностью, так как ионы гидроксида (OH-) являются сильными щелочными ионами. Они способны принимать протоны от кислоты и образовывать воду.
Сильные кислоты: свойства и реакции
Одним из главных свойств сильных кислот является их высокая степень ионизации. При растворении в воде сильные кислоты полностью диссоциируют, образуя ионы водорода H+. Это приводит к образованию кислотных растворов с низким рН-значением. Сильные кислоты также обладают высокой коррозионной активностью и способны разрушать многие материалы, включая металлы.
Сильные кислоты демонстрируют разнообразные реакции. Одним из наиболее известных примеров является реакция с металлами, которая приводит к образованию солей и выделению водорода. Например, реакция хлороводородной кислоты с цинком приводит к образованию хлорида цинка и выделению водорода:
HCl + Zn → ZnCl2 + H2
Кроме того, сильные кислоты могут взаимодействовать с основаниями, образуя соли и воду. Например, реакция между серной кислотой и гидроксидом натрия приводит к образованию сульфата натрия и воды:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
Сильные кислоты также могут реагировать с некоторыми органическими соединениями, образуя соответствующие соли или происходящие под воздействием кислотного окисления вещества.
Сильные кислоты в водных растворах

Сильные кислоты в водных растворах представлены веществами, которые полностью диссоциируются на ионы в воде. Это означает, что все молекулы кислоты разлагаются на ионы воды, что делает раствор кислоты эффективным проводником электричества.
Наиболее распространенными примерами сильных кислот являются серная кислота (H2SO4), хлороводородная кислота (HCl) и соляная кислота (HNO3). Эти кислоты обладают высокой степенью диссоциации и представляют собой сильные электролиты.
| Кислота | Формула |
|---|---|
| Серная кислота | H2SO4 |
| Хлороводородная кислота | HCl |
| Соляная кислота | HNO3 |
Эти кислоты часто используются в различных областях, таких как промышленность, лабораторная диагностика и химические исследования. Они также являются важными компонентами в процессах синтеза различных органических и неорганических соединений.
Сильные кислоты в водных растворах отличаются высокой кислотностью и способностью реагировать с основаниями. Они обладают высокой агрессивностью и способны вызывать ожоги на коже и поражение слизистых оболочек. Поэтому при работе с ними необходимо соблюдать меры предосторожности и использовать соответствующие защитные средства.
Протонизация сильных кислот и их активность
Протонизация сильных кислот происходит практически полностью, поэтому они считаются кислотами с максимальной активностью. Их активность определяется способностью быть донорами протонов и взаимодействовать с основаниями.
Сильные кислоты, такие как соляная кислота (HCl), серная кислота (H2SO4) и нитрированная кислота (HNO3), обладают низким рН и легко отдают протоны в растворе. Этот процесс сопровождается выделением тепла и скорым изменением pH среды.
Важно отметить, что протонизация сильных кислот протекает без образования равновесия, что отличает их от слабых кислот. Сильные кислоты полностью диссоциируют в водном растворе, что означает, что все молекулы кислоты переходят в ионы. Это обусловливает их высокую активность и способность сильно изменять окружающую среду.
Протонизация сильных кислот является ключевым процессом во многих химических реакциях. Кислотно-основные реакции играют важную роль в области катализа, синтеза органических соединений и даже в жизнедеятельности организмов.
Среда: что делает ее более активной?

Активность среды в контексте сильных оснований и сильных кислот зависит от нескольких факторов:
- Концентрация раствора. Чем выше концентрация, тем более активной будет среда. Большая концентрация обеспечивает более сильное воздействие на реагирующие вещества.
- Коэффициент диссоциации. Чем выше коэффициент диссоциации, тем больше ионообразных частиц будет в растворе, что увеличивает активность среды. В сильных основаниях и сильных кислотах коэффициент диссоциации обычно высок.
- Температура реакции. Повышение температуры может увеличить активность среды, так как это увеличивает скорость реакции и степень диссоциации.
- Газообразное состояние. Газообразные реакции часто происходят более активно, так как газы могут быстро диффундировать и взаимодействовать друг с другом.
- Содержание других химических веществ. Наличие других химических веществ может повлиять на активность среды. Например, наличие катализатора может ускорить реакцию и увеличить активность среды.
Все эти факторы в совокупности влияют на активность среды в контексте сильных оснований и сильных кислот. Выбор между сильными основаниями и сильными кислотами зависит от конкретной ситуации и требований эксперимента или процесса.
Факторы, влияющие на активность сильных оснований и кислот
Активность сильных оснований и кислот зависит от нескольких факторов. Некоторые из них влияют на их способность диссоциировать, а другие на скорость реакции. Среди главных факторов можно выделить:
| Фактор | Влияние на активность |
|---|---|
| Концентрация раствора | Чем выше концентрация кислоты или основания, тем выше их активность, так как больше молекул будет диссоциировать |
| Реакция с водой | Некоторые сильные основания и кислоты могут реагировать с водой, создавая слабые кислоты или основания, что снижает их активность |
| Растворимость | Сильные основания или кислоты, имеющие высокую степень растворимости, будут активнее, так как их больше вещества будет в состоянии диссоциировать |
| Температура | Повышение температуры может увеличить скорость реакции и, следовательно, активность сильного основания или кислоты |
| Силы связи | Чем сложнее связи в молекулах сильных оснований или кислот, тем сложнее их диссоциирование и, следовательно, ниже их активность |
Однако, стоит отметить, что активность сильных оснований и кислот может также зависеть от конкретного вещества и его структуры, поскольку различные молекулярные особенности могут влиять на их реакционную способность и эффективность.








