Растворение вещества – процесс, при котором одно вещество (растворимое вещество) растворяется в другом (растворители). Этот физико-химический процесс является одним из важнейших в природе и в промышленности. Растворение обычно происходит при контакте молекул растворимого вещества с молекулами растворителя. В зависимости от природы этих веществ и условий, в которых происходит процесс, могут быть различные механизмы растворения.
Первый и наиболее распространенный механизм растворения – механизм диссоциации. Он характерен для соединений, которые при растворении ионизируются, то есть распадаются на ионы. Примерами таких соединений являются соли, кислоты и основания. Ионы образуют ионные облака, которые окружают себя молекулами растворителя, образуя тем самым равновесную систему между растворимым веществом и его ионами в растворе.
Кроме механизма диссоциации, существуют также другие механизмы растворения, например, механизм сольватации, механизм смешивания и механизм диффузии. Некоторые вещества могут растворяться по нескольким механизмам одновременно, что делает растворение еще более сложным явлением.
Растворение вещества играет важнейшую роль в различных сферах жизни. Например, в медицине растворы используются для введения лекарственных веществ в организм, а в химической промышленности – для производства различных продуктов. Изучение механизмов растворения позволяет улучшить производительность процессов и сократить затраты на производство.
Что такое растворение и зачем оно нужно?

Растворение является важным процессом в химии и имеет множество практических применений. Оно широко используется в различных отраслях народного хозяйства и науки. Например, в медицине растворы используются для приготовления лекарств, инъекций и растворов для внутривенного введения. В пищевой промышленности растворы применяются для производства напитков, соков, соусов и других продуктов. В химической промышленности растворы используются для проведения реакций и получения продуктов, а также в качестве растворителей для различных веществ.
Растворение также играет важную роль в природе. Например, водные растворы питательных веществ в почве позволяют растениям получать необходимые для их жизнедеятельности элементы. Возможность растворения в воде также влияет на формирование рельефа Земли, так как вода может растворять различные минералы и вещества, а затем переносить их и оседать в другом месте.
Основные принципы растворимости веществ
Первый принцип связан с поларностью молекул и межмолекулярными силами. Если молекулы растворимого вещества и растворителя обладают схожей по своей природе полярностью, то вещество является легкорастворимым, а если полярности различаются, то считается, что вещество имеет низкую растворимость. Так, полярные вещества растворяются обычно в полярных растворителях, а неполярные – в неполярных.
Второй принцип растворимости связан с наличием энергии активации. Вещества, между молекулами которых действуют сильные притяжения, в большинстве случаев имеют низкую растворимость. Чтобы произошло растворение таких веществ, необходимо поставить в процесс достаточное количество энергии для разрыва данных притяжений между молекулами растворимого вещества.
Основные принципы растворимости имеют большое значение в химии, так как позволяют предсказывать, какие вещества будут растворяться в определенных условиях. Знание этих принципов помогает в выборе оптимальных растворителей и условий для проведения процессов растворения в различных ситуациях.
Факторы, влияющие на скорость растворения
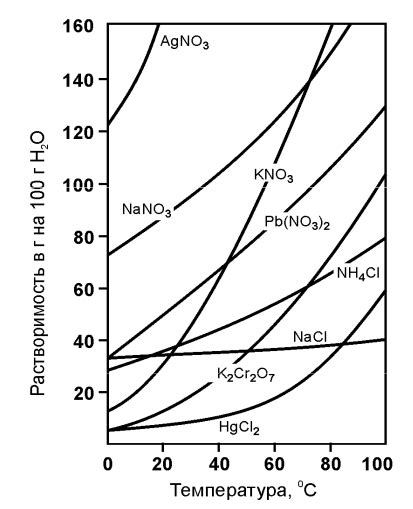
Скорость растворения вещества может быть значительно различной и зависит от нескольких факторов. Понимание этих факторов помогает объяснить и предсказать процесс растворения.
- Температура: Одним из основных факторов, влияющих на скорость растворения, является температура растворителя. В общем случае, при повышении температуры, скорость растворения увеличивается. Это связано с увеличением энергии частиц, что способствует их движению и столкновениям, что, в свою очередь, способствует быстрому процессу растворения.
- Размер растворяемой частицы: Размер частиц вещества, которое растворяется, также влияет на скорость растворения. Частицы меньшего размера имеют большую поверхность, что обеспечивает большую площадь контакта с растворителем. Как результат, более мелкие частицы растворяются быстрее.
- Тип растворителя: Различные вещества могут иметь различные способности растворять другие вещества. Например, вода является универсальным растворителем, способным растворять множество других веществ. Однако, некоторые вещества, такие как масла или неорганические растворители, могут быть менее эффективными в растворении некоторых веществ.
- Агитация или перемешивание: Перемешивание или агитация раствора может существенно повлиять на скорость растворения. Это связано с созданием более равномерного распределения частиц вещества в растворителе и увеличением движения частиц, что способствует их взаимодействию с молекулами растворителя.
- Концентрация вещества: Концентрация растворяемого вещества также может влиять на скорость растворения. В общем случае, при повышении концентрации, скорость растворения увеличивается. Высокая концентрация вещества в растворе способствует более интенсивным столкновениям и взаимодействию частиц растворяемого вещества с растворителем.
Учет этих факторов позволяет более точно предсказывать и контролировать скорость растворения вещества.
Типы реакций растворения
Простая диссоциация - это реакция растворения, в которой ионные вещества разделяются на положительно и отрицательно заряженные ионы. Например, при растворении соли NaCl в воде происходит диссоциация на ионы Na+ и Cl-. Такой тип реакции растворения характерен для многих солей.
Процесс солватации - это реакция растворения, в которой молекулы растворителя объединяются с отдельными молекулами растворяемого вещества. Например, при растворении кристаллического кальция в воде происходит образование ионов Ca2+, которые оседают на поверхности молекул воды. Такой тип реакции растворения характерен для веществ, не образующих ионо-молекулярные соединения.
Продукт гидратации - это реакция растворения, в которой молекулы растворителя встраиваются в сетку кристаллической решетки растворяющегося вещества и образуют продукт гидратации. Например, при растворении кристаллов сульфата меди(II) в воде происходит образование гидрата CuSO4 · 5H2O. Такой тип реакции растворения характерен для веществ, способных образовывать гидраты.
Изучение типов реакций растворения имеет большое значение для понимания механизмов образования растворов различных веществ и применения их в химической промышленности, научных исследованиях и медицине.
Примеры растворимых и нерастворимых веществ

В природе существуют множество веществ, которые могут быть растворимыми или нерастворимыми в различных средах. Растворимость вещества зависит от его химических свойств и параметров среды, в которой оно находится.
Примеры растворимых веществ:
- Соль - наиболее распространенное растворимое вещество. Соли могут растворяться в воде и других растворителях, образуя их растворы. Некоторые примеры солей: хлорид натрия (NaCl), сульфат магния (MgSO4).
- Сахар - еще одно распространенное растворимое вещество. Вода легко растворяет сахар, образуя сладкий раствор. Химическое название сахара - сахароза (C12H22O11).
Примеры нерастворимых веществ:
- Песок - нерастворимое вещество, состоящее из мелких зерен. Он не растворяется в воде или других растворителях.
- Железо - металл, который обычно не растворяется в воде. Однако при взаимодействии с кислородом может образовываться растворимое вещество - ржавчина.
Это лишь некоторые примеры растворимых и нерастворимых веществ. В действительности, их много и каждое вещество имеет свою растворимость в зависимости от условий.
Физический и химический механизмы растворения
Растворение представляет собой физико-химический процесс, в ходе которого вещество, называемое растворителем, проникает в тело другого вещества, называемое растворяемым веществом, образуя равномерную молекулярную смесь. Растворение может осуществляться с помощью физических и химических механизмов.
Физический механизм растворения заключается в разрушении взаимной связи между молекулами растворимого вещества и их перемещении в структуру растворителя без изменения химических свойств растворимого вещества. В процессе растворения молекулы растворителя окружают молекулы растворимого вещества и образуют с ними слабые взаимодействия. Физический механизм растворения применим к разнообразным веществам, в том числе к неметаллическим и металлическим веществам, органическим и неорганическим веществам.
Химический механизм растворения включает в себя изменение строения или состава растворимого вещества в процессе взаимодействия с растворителем. В ходе химического растворения происходит химическая реакция между растворимым веществом и растворителем, в результате чего образуются новые вещества. Химический механизм растворения наблюдается во взаимодействии кислоты с щелочью, растворения электролитов и растворов солей.
Влияние температуры на растворение
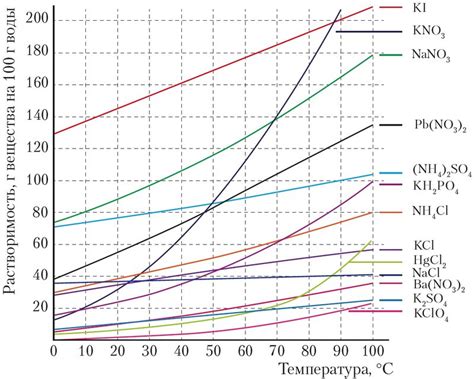
Это связано со сменой энергетических условий в системе. При повышении температуры молекулы вещества получают больше энергии, что приводит к увеличению их движения и столкновения между собой. В результате, реакция растворения становится более интенсивной, а растворимость вещества возрастает.
Наоборот, при понижении температуры энергия молекул уменьшается, что ведет к замедлению кинетики растворения. Молекулы могут медленнее двигаться и реже сталкиваться друг с другом. В результате, растворимость вещества уменьшается и процесс растворения становится менее интенсивным.
Необходимо отметить, что для некоторых веществ изменение температуры может вызывать обратный эффект. Например, с некоторыми солями наблюдается эффект обратимости растворения. При повышении температуры их растворимость увеличивается, в то время как при снижении температуры снова уменьшается.
В целом, влияние температуры на растворение вещества является важным и может быть использовано как способ контроля и изменения растворимости вещества в различных системах.
| Температура, °C | Растворимость вещества, г/100 мл воды |
|---|---|
| 10 | 5 |
| 20 | 10 |
| 30 | 15 |
| 40 | 20 |
Растворение и реакция: какие связи?
В химии растворение вещества является результатом физического процесса, но это не означает, что растворение не может быть связано с химической реакцией. Напротив, растворение может стать стартовой точкой для химической реакции или являться частью реакции.
Примером растворения, которое сопровождается химической реакцией, может служить растворение кислоты в воде. Когда кислота растворяется в воде, происходит реакция с водными молекулами, в результате которой образуются ионы водорода и других веществ. Это взаимодействие между кислотой и водой представляет собой химическую реакцию.
Некоторые растворения могут также происходить без химической реакции, когда происходит физическое смешивание двух или более веществ. В этом случае реакции между веществами не происходят, и растворение считается физическим процессом.
Понимание связи между растворением и реакцией важно для понимания химических процессов и применения их в практике. Знание, какие реакции могут происходить при растворении, позволяет оптимизировать процессы синтеза веществ, улучшить эффективность производственных процессов и разработать новые материалы.
Практическое применение растворения

Растворение вещества имеет широкое практическое применение в различных сферах жизни. Ниже приведены некоторые примеры использования этого процесса:
- Химическая промышленность: растворение является одним из базовых процессов в химической промышленности. Оно используется для получения растворов, которые затем могут быть использованы в производстве различных химических соединений.
- Фармацевтическая промышленность: растворение используется при производстве лекарственных препаратов. Многие лекарственные вещества не могут быть использованы в чистом виде и должны быть растворены в подходящих растворителях для удобства приема или улучшения их биодоступности.
- Пищевая промышленность: растворение применяется при производстве пищевых продуктов. Некоторые ингредиенты, такие как сахар или соль, должны быть растворены в воде или другом растворителе, чтобы быть равномерно распределенными в продукте.
- Аналитическая химия: растворение является важным инструментом в аналитической химии. Многие аналитические методы, такие как хроматография и спектроскопия, основаны на растворении анализируемого вещества в растворителе для проведения исследований и определения его свойств.
- Экология: растворение играет важную роль в экологии при растворении различных веществ в природе. Например, осадки, содержащие растворенные вещества, могут иметь влияние на качество воды в реках и озерах.
Это лишь некоторые примеры использования растворения в различных сферах. Общепринятое понимание механизма растворения и его практическое применение имеет огромное значение в наших повседневных делах и развитии науки и технологии.








