Периоды в таблице Менделеева - это горизонтальные ряды элементов, расположенные в порядке возрастания атомного номера. Они играют важную роль в организации химических элементов и помогают понять их всеобщую систематику. Начало каждого нового периода связано с определенными элементами, имеющими уникальные химические свойства. В этой статье рассмотрим основные особенности и значение элементов, на которых начинаются периоды в таблице Менделеева.
Период 1 начинается с элемента водород (H) - самого легкого и распространенного вещества во вселенной. Водород является основным строительным блоком всего мира и входит в состав большинства органических и неорганических соединений. Благодаря своей простоте и универсальности, водород имеет широкое применение в различных областях науки и техники.
Период 2 начинается с гелий (He) - неметаллического химического элемента, обладающего уникальными свойствами. Гелий является одним из инертных газов и не образует химических соединений с другими элементами. Он обладает очень низкой температурой кипения и широко используется в научных и технических целях, например, в сфере охлаждения и в заполнении аэростатов.
Период 3 начинается с элемента литий (Li) - легкого металла, который обладает высокой электропроводностью и хорошей реактивностью. Литий широко используется в батареях и аккумуляторах, а также в производстве легких и прочных материалов. Научные исследования показывают, что литий может иметь огромный потенциал в энергетике и борьбе с загрязнением окружающей среды.
Каждый новый период в таблице Менделеева открывает новую главу в изучении и понимании химических элементов. Начальные элементы периодов являются ключевыми фигурантами в различных химических процессах и имеют огромное значение для науки и промышленности. Изучение периодов помогает нам лучше понять природу вещества и создать новые материалы и технологии, отвечающие нуждам современной жизни.
Периоды в таблице Менделеева: важные аспекты и элементы
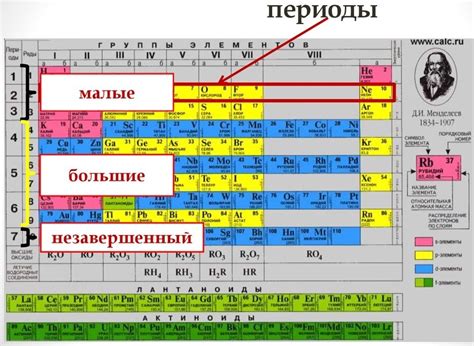
Периоды в таблице Менделеева обладают несколькими основными особенностями:
- Количество периодов равно номеру атомного числа самого тяжелого элемента в таблице Менделеева. На сегодняшний день известно 7 периодов.
- Последний элемент каждого периода имеет свободное электронное место в внешней оболочке, что делает его химически активным.
- Каждый новый период начинается с заполнения новой электронной оболочки.
Периоды в таблице Менделеева включают в себя несколько важных элементов, отражающих принципиальные химические свойства:
- Первый период включает элементы водород (H) и гелий (He), которые являются самыми легкими элементами и обладают особыми свойствами.
- Второй период начинается с лития (Li) и заканчивается неоном (Ne). В нем находятся также бор (B), углерод (C), азот (N), кислород (O) и фтор (F), которые обладают широким распространением и значимыми свойствами.
- Третий период содержит элементы натрий (Na), магний (Mg), алюминий (Al), кремний (Si), фосфор (P), сера (S) и хлор (Cl). Эти элементы широко используются в промышленности и имеют важное значение для жизни организмов.
Каждый новый период добавляет новые элементы и химическое разнообразие в таблицу Менделеева, позволяя химикам и научным исследователям получать новые знания о свойствах и взаимодействиях элементов.
Какие элементы являются начальными в периодах таблицы Менделеева?
Главные характерные черты периодов в таблице Менделеева
Основные черты периодов в таблице Менделеева:
- Увеличение атомных номеров элементов от левого к правому краю периода.
- Постепенное увеличение количества электронных оболочек у элементов.
- Постепенное увеличение радиусов атомов или ионов от левого к правому краю периода.
- Изменение химических свойств элементов от металла к неметаллу вдоль периода.
- Постепенный переход от металлов к неметаллам, через полуметаллы или полупроводники.
- Изменение электроотрицательности элементов от меньшей к большей вдоль периода.
- Постепенное увеличение электроотрицательности в группе элементов, начиная с галогенов и заканчивая инертными газами. Последние являются самыми электроотрицательными элементами в периоде.
Эти особенности периодов в таблице Менделеева позволяют систематизировать знания о различных элементах и проводить предсказания о химическом поведении новых элементов, которые могут быть открыты в будущем.
Что отличает группы элементов от периодов в таблице Менделеева?
Группы элементов в таблице Менделеева представлены вертикальными столбцами, нумерация которых происходит числами от 1 до 18. Группа элементов объединяет в себе элементы с сходными химическими свойствами. Всего в таблице Менделеева существуют 18 групп.
Для группы элементов характерно:
- Одинаковое число валентных электронов во внешнем энергетическом уровне.
- Похожие способы формирования соединений.
- Похожие физические и химические свойства.
- Постепенное изменение этих свойств по мере движения по группе, обусловленное изменением количества энергетических уровней.
Например, элементы группы 1 (щелочные металлы) имеют один валентный электрон во внешнем энергетическом уровне и образуют щелочные оксиды и гидроксиды. Элементы группы 17 (галогены) имеют семь валентных электронов и образуют кислотные оксиды и кислоты. В других группах элементы также имеют сходные свойства.
Периоды в таблице Менделеева представлены горизонтальными рядами, нумерация которых происходит числами от 1 до 7. Периоды в таблице Менделеева показывают количество электронных оболочек (энергетических уровней), на которых располагаются электроны. Всего в таблице Менделеева существует 7 периодов.
Для периода характерно:
- Постепенное увеличение количества электронных оболочек по мере движения по периоду.
- Начало нового периода означает заполнение новой электронной оболочки электронами.
- Изменение химических свойств элементов по мере движения по периоду. Это обусловлено изменением конфигурации электронных оболочек.
- Элементы последнего периода (7) называют газами-инертами, так как они обладают полностью заполненными электронными оболочками и не образуют химических соединений с другими элементами.
Например, элементы первого периода (водород и гелий) имеют одну электронную оболочку и находятся в первом энергетическом уровне. Элементы третьего периода (натрий, магний и т.д.) имеют третью электронную оболочку и находятся в третьем энергетическом уровне.
| Группы | Периоды |
|---|---|
| 1 | 1 |
| 2 | 2 |
| ... | ... |
| 18 | 7 |
Таким образом, группы элементов объединяют элементы с сходными химическими свойствами, основанными на количестве валентных электронов, а периоды отражают изменение свойств элементов в зависимости от количества электронных оболочек или энергетических уровней.
Основные особенности начала каждого периода в таблице Менделеева
Второй период: Начинается с лития (Li). В этом периоде находятся элементы от лития до неона (Ne). Литий и бериллий являются легкими металлами, а бор - металломлохожидкостью. В этом периоде также находятся элементы, которые являются неметаллами - углерод и азот. Примечательно, что второй период содержит все три состояния вещества: газ (азот), жидкость (бор) и твёрдое тело (остальные элементы).
Третий период: Начинается с натрия (Na). В этом периоде находятся элементы от натрия до аргона (Ar). Натрий и калий являются активными металлами, а аргон - инертным газом. В этом периоде наблюдается увеличение размеров атомов элементов и постепенное увеличение ионизационной энергии.
Четвертый период: Начинается с калия (K). В этом периоде находятся элементы от калия до криптона (Kr). В этом периоде также наблюдается увеличение размеров атомов и увеличение ионизационной энергии. Криптон является инертным газом.
Пятый период: Начинается с рубидия (Rb). В этом периоде находятся элементы от рубидия до ксенона (Xe). В этом периоде также наблюдаются аналогичные тенденции - увеличение размеров атомов и увеличение ионизационной энергии. Ксенон является инертным газом.
Шестой период: Начинается с цезия (Cs). В этом периоде находятся элементы от цезия до радона (Rn). В этом периоде также наблюдаются аналогичные тенденции - увеличение размеров атомов и увеличение ионизационной энергии. Радон является инертным газом.








