Кислоты и основания являются одними из основных понятий в химии. Кислоты относятся к классу веществ, которые могут отдавать протоны (H+) в растворе, а основания – к классу веществ, способных принимать протоны. Однако, кислота может также обладать свойствами основания и наоборот – основание может обладать свойствами кислоты, в зависимости от условий.
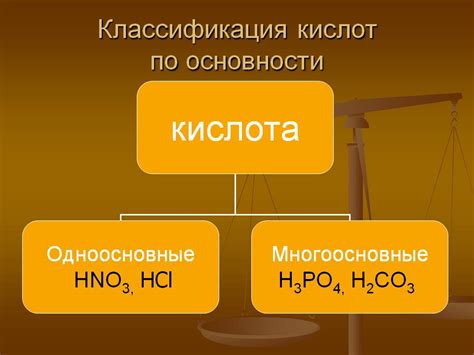
Основность кислоты определяется степенью её диссоциации в водном растворе. Чем больше количество водородных ионов (H+), которое может высвободить кислота при диссоциации, тем сильнее она считается. Сильные кислоты полностью диссоциируются в растворе, тогда как слабые кислоты диссоциируют частично.
Например, серная кислота (H2SO4) является сильной кислотой, так как она полностью диссоциирует в воде, образуя два иона водорода и один ион серы. С другой стороны, уксусная кислота (CH3COOH) является слабой кислотой, так как она диссоциирует частично, образуя ион ацетата и небольшое количество ионов водорода.
Основность кислоты может быть определена также её реакцией с основанием. Кислоты реагируют с основаниями, образуя соль и воду. Чем больше количество водородных ионов, способных отдать кислота, тем более сильной и основной считается эта кислота.
Что такое основность кислоты?

Основность кислоты можно определить с помощью так называемого показателя рН. Показатель рН показывает концентрацию ионов водорода в растворе. Кислые растворы имеют низкий показатель рН (ниже 7), а основные растворы - высокий (выше 7).
Примерами основных кислот могут служить гидроксид натрия (NaOH), гидроксид калия (KOH), гидроксид аммония (NH4OH).
| Вещество | Водное решение | Основность |
|---|---|---|
| Гидроксид натрия | NaOH | Сильная основность |
| Гидроксид калия | KOH | Сильная основность |
| Гидроксид аммония | NH4OH | Слабая основность |
Определение и сущность
Основность кислоты можно определить с помощью ряда методов, таких как измерение водородного показателя (pH) раствора, титрование кислоты с щелочью или использование специальных индикаторов.
Примерами кислот с разной основностью могут служить следующие соединения:
- Соляная кислота (HCl) - сильная кислота, не обладает основностью;
- Уксусная кислота (CH3COOH) - слабая кислота, имеет низкую основность;
- Серная кислота (H2SO4) - сильная кислота, не обладает основностью;
- Фосфорная кислота (H3PO4) - слабая кислота, имеет среднюю основность;
- Угольная кислота (H2CO3) - слабая кислота, имеет низкую основность.
Важные характеристики

Основность кислоты – это одно из основных свойств кислот, которое описывает их способность отдавать протоны в растворе. Каждая кислота имеет определенное значение основности, которое характеризуется постоянной равновесия для реакции протолиза, или диссоциации, кислоты в водном растворе.
Примеры кислот с различными значениями основности:
Соляная кислота (HCl) обладает высокой основностью и диссоциирует в воде практически полностью, отдавая все свои протоны.
Уксусная кислота (CH3COOH) имеет среднюю основность и диссоциирует только частично, отдавая часть своих протонов.
Угольная кислота (H2CO3) является слабой кислотой с низкой основностью и диссоциирует очень медленно в воде, отдавая всего несколько протонов.
Значение основности кислоты определяет ее химическую активность и способность взаимодействовать с другими веществами.
Основы реакции
Реакции различных веществ имеют свои особенности и происходят по определенным правилам. Одними из ключевых понятий химической реакции являются реагенты и продукты.
Реагенты – это начальные вещества, которые участвуют в химической реакции и превращаются в другие вещества. Например, в реакции горения метана (СН4) с кислородом (О2) в качестве реагентов выступают метан и кислород, а в результате реакции образуется углекислый газ (СО2) и вода (Н2О).
Продукты – это вещества, образующиеся в результате химической реакции. В примере с горением метана и кислорода продуктами реакции являются углекислый газ и вода. Они обладают своими характерными свойствами и составом.
Химическая реакция может протекать быстро или медленно в зависимости от условий, при которых она происходит. Факторами, влияющими на скорость реакции, могут быть температура, концентрация веществ, наличие катализаторов и т.д.
Важно помнить, что химическая реакция является закономерным процессом и ее ход можно предсказать, основываясь на знании химических свойств реагирующих веществ. Реакции между кислотами и основаниями являются одними из основных и широко изученных с точки зрения основности кислоты.
Примеры основной природы

2Na + 2H2O → 2NaOH + H2
Гидроксид натрия является основой, так как он диссоциирует в водном растворе, образуя ионы гидроксида (OH-), которые обладают щелочными свойствами.
Еще одним примером основной природы является гидроксид калия (KOH). Он образуется при реакции между калием и водой:
2K + 2H2O → 2KOH + H2
Гидроксид калия также диссоциирует в водном растворе, образуя ионы гидроксида, которые обладают щелочными свойствами.
Это лишь несколько примеров основной природы, и в природе существует множество других основных веществ.
Исключения и особые случаи
Хотя основность кислоты обычно определяется наличием ионов водорода (H+), существуют некоторые исключения и особые случаи, которые следует учитывать при изучении этого понятия.
- Несколько основных атомов в молекуле: Некоторые кислоты могут иметь более одного основного атома в их молекуле. Например, серная кислота (H2SO4) содержит два основных атома водорода и один атом серы.
- Амфотерные вещества: Некоторые вещества могут действовать как кислоты и основания в различных условиях. Такие вещества называют амфотерными. Примером такого вещества является вода (H2O), которая может действовать как кислота, отдавая ион водорода (H+), или как основание, принимая ион водорода (H+).
- Необычные ионы: Некоторые кислоты могут образовывать необычные или нестандартные ионы. Например, фосфорная кислота (H3PO4) образует фосфатные ионы (PO43-), которые могут действовать как основные.
Изучение и понимание исключений и особенностей основности кислоты помогает расширить наши знания о химических свойствах веществ и их взаимодействии.
Значение основности кислот
Основные вещества имеют основность больше 7, а кислоты - меньше 7 на шкале рН. Например, самая сильная кислота - серная, имеет основность 0, а самое основное вещество - гидроксид натрия, имеет основность 14.
Значение основности кислот определяет их физические и химические свойства. Кислоты с большей основностью могут реагировать с основаниями, образуя соли, а также обладают более энергичной кислотной реактивностью. Они также сильнее коррозируют различные материалы.
Основность кислоты играет важную роль в химической промышленности, медицине и жизнедеятельности организмов. Понимание основности кислот позволяет установить соответствующие условия для проведения химических реакций и прогнозировать их результаты.
Завершение и выводы
Примерами основных кислот могут служить серная кислота (H2SO4), хлороводородная кислота (HCl), азотная кислота (HNO3) и фосфорная кислота (H3PO4). Эти кислоты широко используются в промышленности и лабораторной практике.
Знание основности кислоты является необходимым для понимания многих химических реакций. Оно позволяет предсказывать образование солей и воды при взаимодействии кислот и оснований, а также определять реакционную способность кислоты.
В целом, изучение основности кислоты является важным шагом в понимании основных принципов химии и поможет более глубоко разобраться в химических процессах, происходящих в природе и промышленности.








