Основное состояние электрона - это наименее энергетически возбужденное состояние электрона в атоме. В основном состоянии электрон находится в наименьшей возможной энергии и занимает наименьший возможный радиусорбиту.
Когда электрон находится в основном состоянии, его энергия минимальна и не может быть дальше уменьшена на любом радиусе атома. Основное состояние электрона имеет определенные характеристики, которые определяют его поведение и взаимодействие с другими атомами и молекулами.
Основное состояние электрона обладает следующими характеристиками:
1. Энергия: В основном состоянии энергия электрона минимальна и определена конкретным уровнем энергии. При переходе на более высокие энергетические уровни атома, электрон поглощает энергию и переходит в возбужденное состояние.
2. Радиусорбита: В основном состоянии электрон находится на наиболее близкой к ядру орбите. Радиусорбита электрона определяет вероятность его нахождения в конкретной области около ядра.
3. Уровни энергии: Основное состояние электрона соответствует наименьшему уровню энергии атома. В атоме могут быть и другие возбужденные состояния, в которых электрон занимает более высокие энергетические уровни.
Таким образом, основное состояние электрона играет важную роль в атомной физике и химии, определяя свойства и поведение атома. Изучение основного состояния электрона позволяет более глубоко понять структуру атома и его взаимодействие с окружающей средой.
Понятие основного состояния электрона
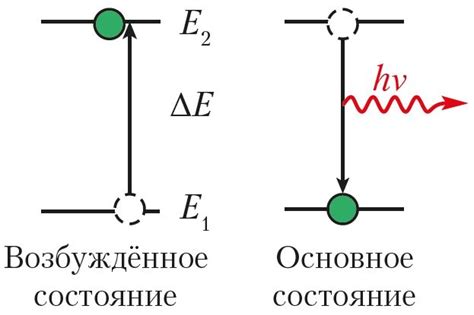
Основное состояние электрона определяет его поведение и взаимодействие с другими атомами. В этом состоянии электрон наиболее стабилен и неактивен, так как любая переходная, более высокоэнергетическая орбиталь, требует дополнительной энергии для возникновения.
Определение основного состояния электрона основывается на принципах квантовой механики, в соответствии с которыми энергетические уровни электронов в атоме дискретны и квантованы. Основное состояние является наименьшим и наиболее стабильным из этих уровней.
Основное состояние электрона также отображает его квантовые числа, которые являются характеристиками его орбитали. Наиболее важными квантовыми числами являются главное квантовое число (n), определяющее энергетический уровень электрона, и орбитальное квантовое число (l), определяющее форму орбитали. Остальные квантовые числа определяют ориентацию орбитали в пространстве.
Объяснение
Основное состояние электрона может быть представлено в виде электронной конфигурации, которая показывает распределение электронов по энергетическим уровням и подуровням в атоме. Наиболее стабильная электронная конфигурация характеризуется полностью заполненными подуровнями и наименьшей возможной энергией для электронов.
Основное состояние электрона определяет его поведение и взаимодействие с другими атомами и молекулами. Например, электроны, находящиеся в невалентных или открытых оболочках, имеют большую реакционную активность и могут участвовать в химических реакциях.
Основное состояние электрона также определяет его энергетический уровень и способность поглощать и излучать энергию в форме света или тепла. Когда электрон переходит на более высокий энергетический уровень, он абсорбирует энергию, а когда он возвращается на основной уровень, излучается свет.
Важно отметить, что основное состояние электрона не является его единственным возможным состоянием. Существуют различные возбужденные состояния, в которых электрон может находиться при поглощении энергии. Однако основное состояние является самым устойчивым и распространенным состоянием для большинства атомов и молекул.
Состояния электрона

Основное состояние электрона обладает следующими характеристиками:
| Характеристика | Значение |
|---|---|
| Орбиталь | 1s |
| Энергия | Основная энергия |
| Магнитный момент | Нулевой магнитный момент |
Основное состояние электрона является самым устойчивым состоянием, в котором электрон находится большую часть времени. Однако, под воздействием внешних факторов, таких как внешние электрические или магнитные поля, электрон может переходить в возбужденные состояния с более высокой энергией и другими квантовыми числами.
Энергия и магнитный момент
Основное состояние электрона в атоме характеризуется его энергией и магнитным моментом. Энергия электрона представляет собой сумму кинетической и потенциальной энергий, которые возникают взаимодействием электрона с ядром атома.
Магнитный момент электрона обусловлен присутствием заряда и его вращением вокруг ядра атома. Он ориентирован вдоль оси вращения электрона и образует силовые линии магнитного поля.
В основном состоянии электрон обладает минимальной энергией и наименьшим значением магнитного момента. Основное состояние является наиболее стабильным состоянием электрона в атоме.
Значение энергии и магнитного момента основного состояния электрона зависит от его квантового числа, которое определяет его энергетический уровень и орбиталь, на которой он движется.
Изменение состояния электрона происходит при поглощении или испускании энергии, например, при возбуждении или релаксации атома. В таких случаях электрон переходит на другой энергетический уровень и его магнитный момент может измениться.
Понимание основного состояния электрона позволяет улучшить нашу модель атома и объяснить множество физических явлений, таких как спектры излучения и поглощения, магнитные свойства веществ и т. д.
Квантовые числа
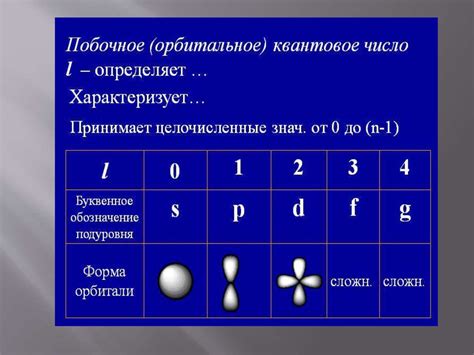
Существует четыре квантовых числа:
| Квантовое число | Обозначение | Допустимые значения |
|---|---|---|
| Главное квантовое число | n | 1, 2, 3, ... |
| Орбитальное квантовое число | l | 0, 1, 2, ..., n-1 |
| Магнитное квантовое число | m | -l, -l+1, ..., 0, ..., l-1, l |
| Спиновое квантовое число | s | -1/2, +1/2 |
Главное квантовое число (n) определяет энергию электрона и размер его орбитали. Чем больше значение n, тем выше энергия и более далеко расположена орбиталь от ядра.
Орбитальное квантовое число (l) характеризует форму орбитали электрона. Значение l зависит от значения n и может принимать целые значения от 0 до (n-1).
Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве относительно заданного направления. Значение m зависит от значения l и может принимать значения от -l до l.
Спиновое квантовое число (s) описывает спин электрона, который может иметь два возможных значения: -1/2 (спин вниз) или +1/2 (спин вверх).
Комбинация всех квантовых чисел позволяет полностью описать основное состояние электрона.
Принцип заполнения электронных оболочек
Принцип заполнения электронных оболочек описывает порядок заполнения энергетических уровней атома электронами.
Согласно принципу Паули, каждый электрон в атоме должен иметь уникальный набор квантовых чисел: главное квантовое число (n), орбитальное квантовое число (l), магнитное квантовое число (m) и спиновое квантовое число (s).
В соответствии с принципом заполнения подуровней, электроны заполняют энергетические уровни, начиная с наименьшей энергии.
На первом энергетическом уровне (n=1) находится только одна s-орбиталь (s-подуровень), которая может содержать максимум 2 электрона.
На втором энергетическом уровне (n=2) находятся s- и p-подуровни. S-подуровень (s-орбиталь) может содержать максимум 2 электрона, а p-подуровень (p-орбитали) может содержать максимум 6 электронов.
На третьем энергетическом уровне (n=3) находятся s-, p- и d-подуровни. S-подуровень (s-орбиталь) может содержать максимум 2 электрона, p-подуровень (p-орбитали) может содержать максимум 6 электронов, и d-подуровень (d-орбитали) может содержать максимум 10 электронов.
Продолжая этот принцип, каждый следующий энергетический уровень содержит новые подуровни с теми же максимальными значениями электронов: s-подуровень (2 электрона), p-подуровень (6 электронов), d-подуровень (10 электронов) и f-подуровень (14 электронов).
Принцип заполнения электронных оболочек помогает понять, какие энергетические уровни заполнены электронами в атоме и как формируются химические связи между атомами.
Основные характеристики

Основные характеристики электрона в своем основном состоянии определяют его поведение и взаимодействие с другими электронами и атомами:
1. Масса электрона: масса электрона равна приблизительно 9.10938356 × 10^-31 килограмм. Электрон является наиболее легким элементарным частицей и обладает отрицательным электрическим зарядом. Масса электрона не зависит от его энергетического состояния.
2. Заряд электрона: электрон обладает отрицательным элементарным электрическим зарядом, который равен -1,602176634 × 10^-19 Кл. Заряд электрона также не зависит от его энергетического состояния.
3. Энергия электрона: энергия электрона в его основном состоянии является минимальной по сравнению с его возбужденными состояниями. Энергия электрона связана с его положением в энергетических уровнях атома.
4. Магнитный момент электрона: электрон обладает магнитным моментом, который связан с его спином и орбитальным моментом импульса. Магнитный момент электрона играет важную роль в его взаимодействии с магнитными полями.
5. Распределение электронной плотности: электрон в своем основном состоянии распределен вокруг ядра атома с использованием электронных облаков, которые представляют собой области пространства с наибольшей вероятностью обнаружения электрона.
Таким образом, основное состояние электрона определяет его основные характеристики, которые играют важную роль в понимании его поведения и взаимодействия с окружающей средой.
Эффекты в основном состоянии
Основное состояние электрона имеет ряд особенностей и влияет на свойства атомов и молекул. Некоторые эффекты, связанные с основным состоянием, включают:
Радиус атома: Радиус атома определяется электронной оболочкой, которая формируется основным состоянием электрона. Чем больше электронов в основном состоянии, тем больше радиус атома.
Ионизационная энергия: Ионизационная энергия – это энергия, необходимая для удаления электрона из атома. В основном состоянии электроны находятся на наименее энергетических орбиталях, поэтому их удаление требует большего энергетического затраты.
Химическая активность: Основное состояние электрона влияет на его химические свойства и активность. Электроны в основном состоянии образуют химические связи и участвуют в химических реакциях, определяя химическую активность атома или молекулы.
Спектральные линии: Когда электрон переходит из возбужденного состояния в основное состояние, он излучает энергию в виде света. Эта энергия соответствует разности энергий между двумя состояниями электрона и проявляется в виде спектральных линий в спектре атомов или молекул.
Магнитное свойство: Основное состояние электрона влияет на его магнитное свойство. Электроны, находящиеся в основном состоянии, имеют определенные магнитные моменты, которые играют важную роль в образовании магнитных материалов и в магнитных свойствах вещества.
Таким образом, основное состояние электрона имеет большое значение в определении свойств атомов и молекул. Оно влияет на их размеры, энергетические характеристики, химическую активность, спектры излучения и магнитные свойства.
Взаимодействие основного состояния с другими электронами
В атомах и молекулах, основное состояние электрона может влиять на энергетические уровни других электронов. Например, если электрон в основном состоянии переходит на более высокий энергетический уровень, освобождающийся энергии может вызвать возбуждение других электронов в системе. Это может привести к образованию временных или постоянных зарядов и изменению химических связей.
Взаимодействие основного состояния с другими электронами также может приводить к обмену электронами и формированию новых химических связей. Например, основной электрон может быть захвачен другим атомом, что приводит к образованию ионов и обмену зарядами. Этот процесс играет важную роль в создании химических соединений и реакциях.
Кроме того, основное состояние также может взаимодействовать с другими электронами через электростатическое притяжение. Это взаимодействие часто определяет строение атома или молекулы, так как электроны в основном состоянии образуют облако электронной плотности, которое может быть притянуто к ядру или другим электронам.
Таким образом, взаимодействие основного состояния электрона с другими электронами является ключевым фактором в понимании химических свойств и реакций. Оно определяет энергетические уровни, химические связи и строение атомов и молекул, и играет важную роль во многих химических процессах и явлениях.
Примеры основного состояния в разных системах
В многие другие атомы и ионы также может существовать основное состояние, в котором электрону присущи определенные квантовые числа, определяющие его энергию и момент импульса.
В сложных системах, таких как молекулы, основное состояние может быть более сложным и зависеть от многочисленных факторов, таких как электронные конфигурации атомов и химическая связь. В общем случае, основное состояние молекулы определяется энергетическими уровнями электронных орбиталей и структурой молекулярных орбиталей.
| Система | Примеры основного состояния |
|---|---|
| Атом водорода | Электрон на орбитали с квантовыми числами n=1 и l=0. |
| Атом гелия | Два электрона: первый на орбитали с квантовыми числами n=1 и l=0, второй на орбитали с квантовыми числами n=1 и l=1. |
| Ион кислорода | Валентный электрон на орбитали с квантовыми числами n=2 и l=1. |
| Молекула воды | Основное состояние определяется электронными состояниями атомов кислорода и водорода, а также химической связью между ними. |








