Одинаковая электроотрицательность - это свойство атомов вещества равномерно притягивать электроны в химической связи. Когда у двух атомов есть одинаковая электроотрицательность, они делят электроны равномерно и образуют так называемую неполярную ковалентную связь. В неполярных ковалентных связях электроны проводят время равномерно между двумя связанными атомами, создавая сильную связь между ними.
Когда атомы имеют разную электроотрицательность, возникает полярная ковалентная связь. В таких связях электроны проводят больше времени возле атома с более высокой электроотрицательностью, создавая разделение зарядов. Это приводит к образованию диполя и возникновению межмолекулярных сил притяжения, таких как диполь-дипольные силы или водородные связи.
Когда атомы обладают одинаковой электроотрицательностью, они полностью равны в своей способности притягивать электроны. Подобные атомы могут образовывать неполярные ковалентные связи, в которых электроны делятся равномерно, создавая сильную связь между атомами. Однако, когда электроотрицательность двух атомов отличается, возникают полярные ковалентные связи, характеризующиеся разделением зарядов и образованием межмолекулярных сил притяжения.
Понятие электроотрицательности

Если атомы, образующие химическую связь, имеют разные значения электроотрицательности, то образуется полярная связь. В такой связи электроны больше времени проводят у атома с более высокой электроотрицательностью, что делает этот атом частично отрицательно заряженным, а атом с более низкой электроотрицательностью - частично положительно заряженным. Полярные связи возникают, например, между атомами водорода и атомами кислорода или азота в молекулах воды или аммиака.
Если атомы имеют одинаковые значения электроотрицательности, то образуется неполярная связь. В неполярной связи электроны проводят равное количество времени у каждого атома, поэтому такая связь не имеет полярности. Примером неполярной связи является связь между атомами водорода в молекуле газа пропана.
Важно отметить, что электроотрицательность атомов оказывает существенное влияние на химические свойства веществ, взаимодействия их с другими веществами, а также на вид и свойства образующихся химических соединений.
Однородность электроотрицательности
Когда атомы соединяются, разница в их электроотрицательности может оказывать влияние на тип химической связи, образуемой между ними. Если атомы обладают одинаковой электроотрицательностью, то говорят о ситуации однородной электроотрицательности.
Однородность электроотрицательности приводит к образованию неполярной химической связи, когда электроны между атомами равномерно распределяются. В таких случаях атомы не показывают сильное влечение друг к другу и образуют молекулы, в которых нет электрического заряда.
Примером неполярной связи является молекула кислорода (O2), состоящая из двух одинаковых атомов. Их электроотрицательности равны, поэтому электроны между ними равномерно распределены. В результате образуется неполярная связь, благодаря которой молекулы кислорода обладают нулевым электрическим зарядом.
Однако, важно отметить, что однородная электроотрицательность не является единственным фактором, влияющим на тип химической связи. Разница в размере атомов, их электронная конфигурация и другие факторы также могут оказывать существенное влияние.
Определение электроотрицательности

Обычно электроотрицательность атома измеряется шкалой Полинга. В этой шкале самое большое значение электроотрицательности присваивается флуору – 4,0, а самое маленькое – цезию и францию – 0,7. Другие элементы имеют значения электроотрицательности между этими крайними значениями.
Если атомы, участвующие в химической связи, имеют одинаковую электроотрицательность, то такая связь называется неполярной координативной или атомарной. В неполярной связи электроны равномерно распределены между атомами. Неполярные связи могут существовать между атомами одного и разных элементов.
Неполярные связи обладают определенной прочностью и могут быть ионными или ковалентными. В ионных неполярных связях происходит перенос электронов от металла к неметаллу. Ковалентные неполярные связи возникают в молекулах, где электроотрицательности атомов практически равны.
Влияние одинаковой электроотрицательности на химические связи
Если два атома имеют одинаковую электроотрицательность, это означает, что они обладают равной способностью притягивать электроны. В таком случае, образующаяся связь будет называться неполярной ковалентной связью. В неполярной ковалентной связи электроны равномерно распределены между двумя атомами и не смещаются в сторону одного из них. Такие связи могут образовываться между атомами одного химического элемента или между атомами разных элементов с одинаковой электроотрицательностью.
Неполярные ковалентные связи обладают особыми свойствами. Они являются самыми сильными из всех типов химических связей и обладают высокой устойчивостью. Кроме того, молекулы с неполярными ковалентными связями обычно нерастворимы в полярных растворителях и обладают низкой температурой кипения и плавления.
Примером химической связи с одинаковой электроотрицательностью может служить связь между двумя атомами кислорода в молекуле кислорода (O2). Оба атома кислорода имеют одинаковую электроотрицательность, что способствует образованию неполярной ковалентной связи.
В общем, одинаковая электроотрицательность атомов влияет на тип и силу образующейся химической связи. Неполярные ковалентные связи, образованные между атомами с одинаковой электроотрицательностью, обладают специальными свойствами и играют важную роль в химических реакциях и структуре веществ.
Формирование ковалентной связи
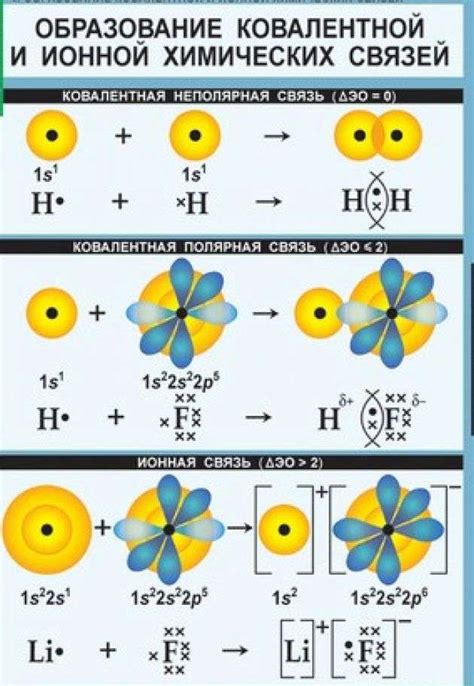
Формирование ковалентной связи происходит благодаря взаимному притяжению электронов внешней оболочки атомов. В процессе образования связи, каждый атом делится с другим атомом по одному электрону, образуя пару связанных электронов между собой. Такая пара электронов называется электронной парой, а общая электронная пара, образованная двумя атомами, является связью между ними.
Ковалентная связь может образовываться между атомами различных элементов или между атомами одного элемента. В случае образования связи между атомами одного элемента говорят о молекуле элемента. В случае образования связи между атомами различных элементов говорят о молекуле химического соединения.
При образовании ковалентной связи, количество электронов во внешней оболочке атомов остается неизменным. Атомы делят электроны таким образом, чтобы у каждого атома был полный октет электронов во внешней оболочке, кроме водорода и гелия, у которых октет может считаться полным с двумя электронами.
Ковалентная связь является наиболее прочной из всех типов химических связей и обычно образуется между не металлами. Она играет важную роль во многих химических реакциях и определяет свойства молекул и соединений.
Особенности и силы химических связей при одинаковой электроотрицательности
Два атома с одинаковой электроотрицательностью будут иметь равномерное распределение электронов вокруг связи, что называется неполярной ковалентной связью. В такой связи электроны будут проводить равное количество времени около обоих атомов, создавая равные положительные и отрицательные заряды.
Эта ситуация наблюдается, например, в молекуле кислорода (O2), где два атома кислорода имеют одинаковую электроотрицательность. В такой молекуле электроны равномерно распределены между атомами, что позволяет им образовывать неполярные ковалентные связи между собой.
В случае молекул с атомами, имеющими одинаковую электроотрицательность, силы химической связи будут слабее, чем в случае атомов с разной электроотрицательностью. Это объясняется тем, что в неполярных ковалентных связях электроны проводят больше времени в окрестности связи и отталкиваются друг от друга. Поэтому такие связи обычно имеют меньшую энергию связи.
Однако, даже при одинаковой электроотрицательности атомов, силы химической связи могут быть различными в зависимости от других факторов, таких как стерические эффекты или конформация связанных молекул.








