Нитрат магния - химическое соединение, состоящее из ионов магния и нитрата. Этот белый кристаллический порошок обладает рядом уникальных свойств и широко используется в различных отраслях промышленности. Изучение реакций данного соединения позволяет понять его химическую активность и найти применение в различных процессах.
Нитрат магния имеет высокую степень растворимости в воде, что делает его удобным объектом для исследования реакций в растворе. Одной из основных реакций, в которых участвует этот соединение, является гидролиз. Гидролиз нитрата магния происходит в растворе и приводит к образованию нитрита и гидроксида магния. Эта реакция является важным шагом в процессе получения различных продуктов на основе нитрата магния.
Кроме того, нитрат магния может быть использован в качестве источника магния в различных химических реакциях. Магний, содержащийся в нитрате магния, может реагировать с кислотами, оксидами и многими другими соединениями. Это открывает широкие возможности для применения нитрата магния в производстве различных химических продуктов и материалов, включая удобрения, огнезащитные покрытия, керамику и стекло.
Основные реакции с нитратом магния
- Реакция диссоциации: при нагревании нитрат магния разлагается на оксид магния (MgO), оксид азота (NO2) и кислород (O2). Уравнение реакции: 2Mg(NO3)2 → 2MgO + 4NO2 + O2
- Реакция соляной кислоты: нитрат магния растворяется в соляной кислоте с образованием хлорида магния (MgCl2) и оксида азота (NO2). Уравнение реакции: Mg(NO3)2 + 2HCl → MgCl2 + 2NO2 + H2O
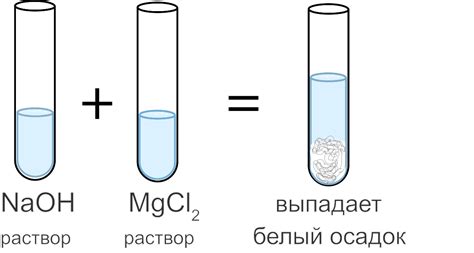
- Реакция с гидроксидом натрия: нитрат магния образует осадок гидроксида магния (Mg(OH)2) и раствор натрата натрия (NaNO3) при взаимодействии с гидроксидом натрия. Уравнение реакции: Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
- Реакция с аммиаком: взаимодействие нитрата магния с аммиаком приводит к образованию осадка гидроксида магния (Mg(OH)2) и раствора аммония нитрата (NH4NO3). Уравнение реакции: Mg(NO3)2 + 2NH3 + 2H2O → Mg(OH)2 + 2NH4NO3
В промышленности нитрат магния используется в качестве источника магния и азота при производстве удобрений. Он также применяется в процессе пропитки дерева для защиты от гниения и насекомых. В научных исследованиях нитрат магния можно использовать в качестве окислителя или катализатора при реакциях окисления.
Реакция нитрата магния с серной кислотой
При смешении нитрата магния с серной кислотой происходит реакция нейтрализации, в результате которой образуются соли магния (MgSO4) и нитрат серебра (AgNO3).
Уравнение реакции:
Mg(NO3)2 + H2SO4 → MgSO4 + 2HNO3
Эта реакция является экзотермической, то есть сопровождается выделением тепла. В результате реакции образуется белая кристаллическая соль магния (MgSO4), которая обладает важными применениями в различных областях.
Применение нитрата магния:
Нитрат магния широко используется в сельском хозяйстве для улучшения плодородия почв. Он является важным компонентом многих удобрений, которые помогают растениям получать достаточное количество необходимых им элементов для роста и развития.
Кроме того, нитрат магния также используется в производстве взрывчатых веществ, горючих смесей, стекла и керамики.
Таким образом, реакция нитрата магния с серной кислотой является важным химическим процессом, который приводит к образованию полезных продуктов и находит широкое применение в различных отраслях промышленности и сельском хозяйстве.
Реакция нитрата магния с гидроксидом натрия

Химическое уравнение реакции:
Mg(NO3)2 + 2NaOH → Mg(OH)2 + 2NaNO3
Полученный осадок – гидроксид магния (Mg(OH)2) – обладает высокой щелочностью и используется как лекарственное и антисептическое средство. Гидроксид магния также применяется в процессе обезжиривания и отбеливания текстильных изделий, а также в производстве керамики, стекла и других промышленных материалов.
Реакция нитрата магния с хлоридом кальция
Реакция нитрата магния (Mg(NO3)2) с хлоридом кальция (CaCl2) протекает при взаимодействии этих двух соединений в растворе.
Основная химическая реакция между нитратом магния и хлоридом кальция выглядит следующим образом:
Mg(NO3)2 + CaCl2 → MgCl2 + Ca(NO3)2
В результате данной реакции образуются хлорид магния (MgCl2) и нитрат кальция (Ca(NO3)2).
Хлорид магния представляет собой бесцветные кристаллы, растворимые в воде. Он широко используется в различных отраслях промышленности, в медицине, а также как антизамерзающее вещество.
Нитрат кальция также является бесцветным веществом, растворимым в воде. Этот соединение находит применение в сельском хозяйстве как удобрение для улучшения питательных свойств почвы.
Таким образом, реакция нитрата магния с хлоридом кальция приводит к образованию двух растворимых соединений – хлорида магния и нитрата кальция, которые имеют свои важные практические применения.
Реакция нитрата магния с карбонатом натрия

Уравнение реакции можно записать следующим образом:
Мg(NO3)2 + Na2CO3 → 2NaNO3 + MgCO3
При проведении данной реакции образуются белый осадок карбоната магния, который можно наблюдать в растворе.
Применение данной реакции находит в химическом анализе для определения наличия и количества ионов магния и натрия в растворе. Нитрат магния, как и другие соли магния, используется в медицине, в качестве удобрений, а также в различных химических процессах.
Реакция нитрата магния с аммиаком
Эта реакция проводится путем внесения раствора нитрата магния в раствор аммиака. В результате образуется ярко-желтый осадок, который состоит из образовавшегося соединения.
Следует отметить, что это соединение очень стабильное и слабо растворимо в воде. Оно хорошо растворяется в аммиаке, образуя ярко-желтый раствор. Это свойство позволяет использовать реакцию нитрата магния с аммиаком в практике для получения красящих веществ, а также в аналитической химии для определения содержания магния в различных образцах.
Таким образом, реакция нитрата магния с аммиаком представляет большой интерес как с точки зрения фундаментальной науки, так и практических применений.
Реакция нитрата магния с фосфатами

При реакции нитрата магния с фосфатами образуется осадок магния фосфата (Mg3(PO4)2), который обладает высокой степенью растворимости. Это означает, что магния фосфат будет осаждаться в виде мелких кристаллов или агрегатов, которые могут быть легко разрушены и отделимы от раствора.
Данная реакция также является важной в химическом анализе, так как магния фосфат может использоваться в качестве индикатора для обнаружения и количественного определения фосфата в растворах. Эта реакция может быть использована для измерения содержания фосфата в различных образцах, таких как почва, вода и пищевые продукты.
Следует отметить, что реакция нитрата магния с фосфатами является эндотермической, что означает, что она требует поступления энергии для ее осуществления. Для проведения данной реакции обычно используют нагревание или добавление катализаторов, чтобы ускорить процесс.
Реакция нитрата магния с нитратом калия
Нитрат магния (Mg(NO3)2) и нитрат калия (KNO3) могут реагировать между собой, образуя новые соединения и проявляя определенные свойства. Эта реакция может быть полезной в различных областях науки и промышленности.
Реакция между нитратом магния и нитратом калия может привести к образованию нитрата калия и нитрата магния:
- Mg(NO3)2 + 2KNO3 → Mg(NO3)2 + 2KNO3
Эта реакция может происходить при смешивании растворов нитрата магния и нитрата калия.
Применение этой реакции может быть разнообразным:
- Использование полученного нитрата калия и нитрата магния в качестве удобрений для растений.
- Применение в химическом анализе для определения присутствия и концентрации нитратов в образцах.
- Производство пиротехнических смесей, так как нитраты являются одним из основных компонентов пиротехнических формул.
Реакция нитрата магния с нитратом калия может иметь и другие применения в зависимости от требуемого результата. Эта реакция является одной из многих возможных комбинаций, которые могут образоваться между различными соединениями нитратов.
Реакция нитрата магния с ацетатом свинца

Реакция между нитратом магния (Mg(NO3)2) и ацетатом свинца (Pb(CH3COO)2) происходит при контакте водных растворов этих соединений. При взаимодействии образуются осадок свинца (Pb) и растворный ацетат магния (Mg(CH3COO)2).
| Реагенты | Реакционные условия | Результат |
|---|---|---|
| Нитрат магния (Mg(NO3)2) | Водный раствор | - |
| Ацетат свинца (Pb(CH3COO)2) | Водный раствор | - |
Реакция протекает по химическому уравнению:
Mg(NO3)2 + Pb(CH3COO)2 → Pb + Mg(CH3COO)2
Данная реакция имеет практическое применение при получении осадка свинца в лабораторных условиях или в технологическом процессе. Ведь осадок свинца широко используется в различных отраслях промышленности, таких как производство кабелей, свинцовых аккумуляторов, косметики, красок и покрытий. Растворный ацетат магния также находит применение в химической промышленности, фармацевтике и других отраслях.
Применение нитрата магния
Одним из основных применений нитрата магния является его использование в качестве удобрения. Он содержит необходимые растениям макроэлементы – азот и магний. Нитрат магния способствует росту растений, укреплению стеблей, улучшению поглощения питательных веществ и укоренению корней. Это делает его идеальным выбором для удобрения различных культур, таких как овощи, фрукты, зерновые и др.
Кроме того, нитрат магния используется в производстве огнетушителей. Благодаря своим огнезащитным свойствам, это соединение способно эффективно тушить различные виды пожаров. Оно подавляет горение и предотвращает его распространение.
Также нитрат магния находит применение в медицине. Он используется в составе препаратов для лечения дефицита магния в организме. Магний играет важную роль в работе сердца, мышц, нервной системы и позволяет поддерживать нормальный обмен веществ. Поэтому нитрат магния может быть назначен для лечения и профилактики различных заболеваний.
Нитрат магния также используется в качестве реагента в химической промышленности. Он применяется для синтеза других химических соединений, таких как оксид магния, хлорид магния и др. Благодаря своим химическим свойствам, нитрат магния является важным компонентом многих процессов, применяемых в производстве различных химических продуктов.
Важно отметить, что нитрат магния следует использовать с осторожностью и соблюдать указанные дозировки и рекомендации. В случае сомнений или необходимости консультации, рекомендуется обратиться к специалисту.








