Несолеобразующие оксиды - это вещества, образующиеся в результате химических реакций, в которых материалы вступают в контакт с окислителями. В отличие от солеобразующих оксидов, несолеобразующие оксиды не образуют соли при реакции с кислотами. Вместо этого они выполняют другие важные функции в химических процессах.
Функции несолеобразующих оксидов могут быть различными и зависят от их химического состава и свойств. Один из наиболее распространенных несолеобразующих оксидов - углекислый газ (СО2). Он играет важную роль в природных и промышленных процессах. Углекислый газ является продуктом горения и выдыха живых организмов, а также формируется в результате некоторых химических реакций.
Углекислый газ выполняет несколько функций. Во-первых, он является одним из главных газов в атмосфере Земли и выполняет функцию парникового газа, способствуя удерживанию тепла от солнечного излучения и предотвращению разрушения озонового слоя. Кроме того, углекислый газ играет важную роль в фотосинтезе растений, являясь их основным источником углерода для синтеза органических соединений. Он также используется в промышленности в качестве сырья для производства различных материалов и веществ.
Несолеобразующие оксиды: определение и роль в химии

Роль несолеобразующих оксидов в химии весьма значительна. Они могут быть использованы как окислители или восстановители во многих химических реакциях. Некоторые из них являются важными промышленными сырьевыми материалами и используются в производстве различных продуктов.
- Углекислый газ (CO2) - наиболее известный несолеобразующий оксид. Он играет важную роль в природных и геологических процессах, таких как фотосинтез растений и газообмен в атмосфере.
- Диоксид серы (SO2) - основной источник сернистого загрязнения атмосферы. Он может приводить к образованию кислотного дождя и других экологических проблем.
- Оксид азота (NOx) - образуется при сгорании топлива и может приводить к загрязнению воздуха и образованию смога. Отрицательно влияет на здоровье человека и экосистемы.
Несолеобразующие оксиды также имеют другие важные функции. Некоторые из них используются в производстве стекла, керамики и других материалов. Они могут также применяться в качестве катализаторов в химических реакциях.
Исследования несолеобразующих оксидов позволяют расширить наши знания о химии и применить их в различных отраслях - от экологии до производства различных материалов и изделий.
Оксиды: основные понятия и свойства
Одним из основных свойств оксидов является их химическая активность. Многие оксиды обладают способностью реагировать с водой, давая кислоты или основания. Это свойство позволяет оксидам выполнять функцию солеобразователей. Они могут быть использованы для получения солей при реакции с соответствующими кислотами или основаниями.
Оксиды также могут принимать участие в реакциях окисления и восстановления. Они могут окисляться, отдавая кислород, или восстанавливаться, принимая кислород. Это свойство делает оксиды важными в процессах сгорания, резкой атмосферы и других химических реакций.
Другим важным свойством оксидов является их физическое состояние при обычных условиях. Некоторые оксиды образуют газы, такие как оксид азота или оксид углерода, другие - жидкости или твердые вещества, например, оксиды железа или оксид алюминия.
| Наименование оксида | Химическая формула | Физическое состояние |
|---|---|---|
| Оксид азота | NO | газ |
| Оксид углерода | CO | газ |
| Оксид железа(III) | Fe2O3 | твердое вещество |
| Оксид алюминия | Al2O3 | твердое вещество |
Оксиды также могут обладать различной степенью кислотности или основности. Некоторые оксиды образуют кислотные растворы при взаимодействии с водой, другие - щелочные растворы. Это свойство зависит от электроотрицательности элемента, из которого состоит оксид. Кислотные оксиды соединяются с водой и образуют кислоты, а щелочные оксиды образуют основания.
В заключение, оксиды представляют собой важные химические соединения, которые выполняют различные функции в химических процессах. Их свойства и роль в реакциях можно объяснить на основе их состава и структуры, а также взаимодействия с другими веществами.
Виды и классификация оксидов
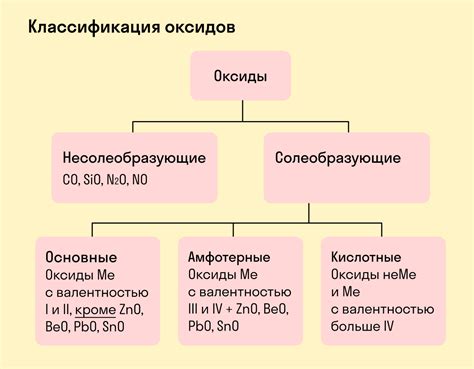
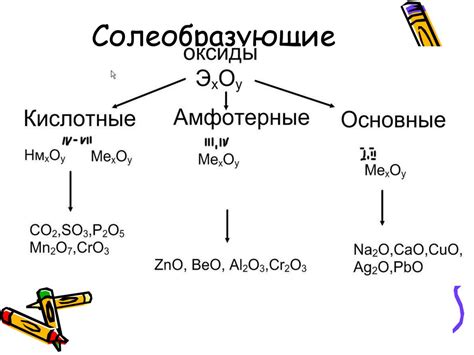
1. Кислотные оксиды - это оксиды, которые образуют кислоты в растворах. Они диссоциируют в воде, образуя кислоты. Примерами кислотных оксидов являются оксид серы (SO2), оксид азота (NO2) и оксид углерода (CO2).
2. Основные оксиды - это оксиды, которые образуют основания в растворах. Они реагируют с водой, образуя гидроксиды (основания). Примерами основных оксидов являются оксид натрия (Na2O), оксид кальция (CaO) и оксид калия (K2O).
3. Амфотерные оксиды - это оксиды, которые могут образовывать как кислотные, так и основные свойства. Они могут реагировать как с кислотами, так и с основаниями. Примерами амфотерных оксидов являются оксид алюминия (Al2O3), оксид железа (Fe2O3) и оксид цинка (ZnO).
4. Нейтральные оксиды - это оксиды, которые не проявляют кислотные или основные свойства. Они обычно являются структурными составляющими минералов и горных пород. Примерами нейтральных оксидов являются оксид кремния (SiO2), оксид алюминия (Al2O3) и оксид железа (Fe2O3).
5. Разъедающиеся оксиды - это оксиды, которые реагируют с водой, образуя кислоты или основания, и разрушаются в процессе. Примерами разъедающихся оксидов являются оксид калия (K2O), оксид натрия (Na2O) и оксид кальция (CaO).
6. Несолеобразующие оксиды - это оксиды, которые не образуют соли при реакции с кислотами или основаниями. Они обычно проявляют свойства кислотных или основных оксидов, но не могут образовывать соли. Примерами несолеобразующих оксидов являются оксид серы (SO2), оксид азота (NO2) и оксид углерода (CO2).
Химические реакции несолеобразующих оксидов
Несолеобразующие оксиды, как следует из их названия, не образуют соли при реакции с кислотой. Однако они могут участвовать в других химических реакциях, обладая различными функциями и свойствами. Химические реакции, в которых участвуют несолеобразующие оксиды, могут происходить как в газовой, так и в жидкой фазе.
Одной из распространенных реакций несолеобразующих оксидов является их реакция с водой. В результате этой реакции образуется кислота и получается новое вещество. Например, углекислый газ (CO2) образует угольную кислоту при реакции с водой:
CO2 + H2O → H2CO3
Также несолеобразующие оксиды могут участвовать в реакциях окисления-восстановления. Например, они могут быть окислены кислородом или восстановлены при реакции с веществами, обладающими сильным окислительным или восстановительным потенциалом. Эти реакции играют важную роль в процессах сжигания топлива и в электрохимических процессах.
Оксиды, такие как оксид углерода (CO), азота (NO) и серы (SO2), могут причинять негативное воздействие на окружающую среду, так как являются причинами загрязнения воздуха и образования кислотных осадков. Они также могут участвовать в формировании смога и атмосферных осадков.
В целом, химические реакции несолеобразующих оксидов имеют широкое применение в различных отраслях науки и промышленности. Изучение этих реакций позволяет понять и контролировать процессы, происходящие в химических системах, а также разрабатывать новые материалы и технологии.
Значение и применение несолеобразующих оксидов
В экологии несолеобразующие оксиды играют важную роль как один из основных источников загрязнений атмосферы. Воздействие несолеобразующих оксидов на окружающую среду может быть разрушительным и иметь негативные последствия для здоровья людей и животных.
Многие несолеобразующие оксиды, такие как оксид азота и оксид серы, являются основными компонентами атмосферного загрязнения. Они образуются в результате сгорания топлива, промышленных процессов и других источников и выбрасываются в атмосферу.
Однако несолеобразующие оксиды также имеют применение в различных областях науки и промышленности. Например, оксиды металлов, такие как оксид алюминия и оксид кремния, используются в производстве керамики, стекла и других материалов. Они обладают высокой термической и химической стабильностью, что делает их полезными для различных технологических процессов.
Несолеобразующие оксиды также имеют важное значение в медицине. Например, оксид азота широко используется как анестетик и расслабляющий агент при проведении хирургических операций. Он также используется в лечении некоторых заболеваний дыхательной системы.
В итоге, несолеобразующие оксиды имеют большое значение в различных областях науки и промышленности. Они выполняют различные функции, от загрязнения атмосферы до использования в производстве материалов и медицине. Понимание и эффективное использование несолеобразующих оксидов являются важными задачами для экологов, ученых и инженеров.








