Связи между атомами играют важную роль в химии, определяя структуру и свойства веществ. Существует несколько типов связей, самыми распространенными из которых являются ковалентная, полярная и неполярная связи. Каждый тип связи обладает своими характерными чертами и способен оптимизировать энергию молекулы.
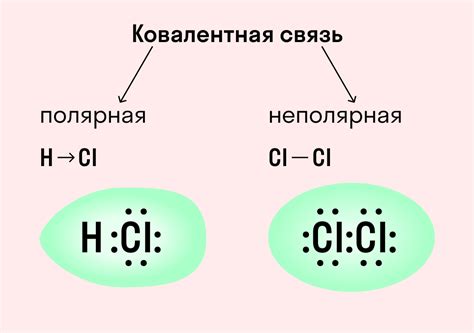
Ковалентная связь - это тип связи, в котором два атома обменивают электроны, образуя так называемую молекулярную пару. Ковалентная связь обладает высокой энергией и прочностью, что делает ее одной из самых стабильных связей. Примером ковалентной связи может служить молекула воды (H2O), где кислород образует две ковалентные связи с водородом.
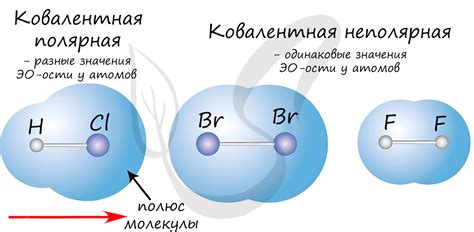
Полярная связь возникает, когда атомы в связи неодинаково делят электронную пару. В результате один атом приобретает отрицательный заряд, а другой - положительный. Полярные связи обладают дипольными моментами и часто возникают между атомами с разными электроотрицательностями. Примером полярной связи может служить связь между водородом и хлором в молекуле HCl.
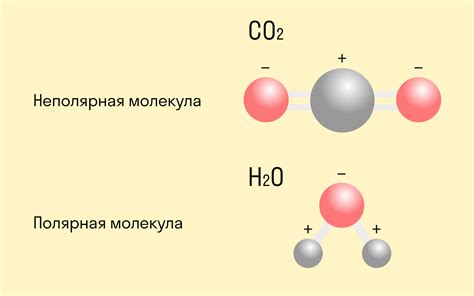
Неполярная связь возникает, когда атомы в связи одинаково делят электронную пару. В результате образуется неполярная молекула, в которой нет значительного разделения зарядов. Пример неполярной связи может привести связь между атомами кислорода (O2) или атомами азота (N2) в молекулярном азоте.
Понимание различий между ковалентной, полярной и неполярной связью может быть полезно при изучении свойств и реакций веществ в химии. Знание этих концепций позволяет вам более глубоко понять взаимодействие между атомами и молекулами, а также применять его в передовых технологиях и промышленности.
Ковалентная связь: как она работает и примеры
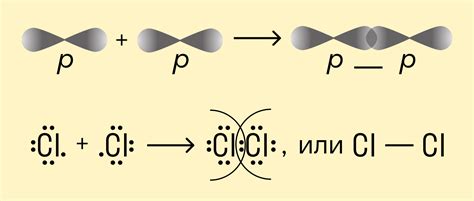
Ковалентная связь образуется в молекулярных веществах и некоторых соединениях, таких как вода. Она определяет форму и структуру молекулы. Чтобы произошло образование ковалентной связи, атомы должны иметь свободные электронные орбитали. Общее количество электронов в ковалентной связи равно восьми - это правило октета.
Примеры ковалентной связи:
- Молекулярный кислород (O2): В этой молекуле два атома кислорода образуют ковалентную связь, в результате чего они делят пару электронов.
- Метан (CH4): В молекуле метана один атом углерода связан с четырьмя атомами водорода через ковалентные связи.
- Диоксид углерода (CO2): Два атома кислорода связаны с атомом углерода через две ковалентные связи.
Ковалентная связь является одним из наиболее распространенных типов химических связей в мире и играет важную роль в химических реакциях и свойствах веществ.
Изучение ковалентной связи
Изучение ковалентной связи включает в себя анализ строения молекулы и распределения электронов между атомами. Для этого широко используются методы химического анализа, такие как спектроскопия и рентгеноструктурный анализ. С помощью этих методов исследователи могут определить тип ковалентной связи, длину и углы между атомами, а также другие характеристики молекулы.
Одним из примеров ковалентной связи является связь между атомами в молекуле воды. В молекуле воды атомы кислорода и два атома водорода образуют ковалентные связи, в результате чего образуется треугольное строение. Молекула воды имеет полярность из-за разности электроотрицательностей атомов, что делает ее полюсной.
Изучение ковалентной связи имеет важное значение в различных областях, таких как органическая и неорганическая химия, биохимия и физика. Понимание принципов и свойств ковалентной связи помогает ученым и инженерам разрабатывать новые материалы, лекарства, катализаторы и другие химические соединения.
Примеры ковалентной связи
- Молекула воды (H2O): каждый атом водорода делит свои электроны с атомом кислорода, образуя две ковалентные связи.
- Молекула аммиака (NH3): атом азота связывается с тремя атомами водорода, образуя три ковалентные связи.
- Молекула метана (CH4): атом углерода связывается с четырьмя атомами водорода, образуя четыре ковалентные связи.
- Молекула аминокислоты глицина (C2H5NO2): атомы углерода, кислорода, азота и водорода образуют между собой несколько ковалентных связей.
- Молекула диоксида углерода (CO2): два атома кислорода связаны с одним атомом углерода, образуя две ковалентные связи.
Эти примеры демонстрируют, что ковалентная связь играет важную роль в образовании химических соединений и обладает различными свойствами в зависимости от типа атомов, связанных в молекуле.
Полярная связь: что это и как она отличается от ковалентной
В отличие от неполярной связи, в которой электроотрицательность атомов одинакова или очень близка, в полярной связи электроотрицательность одного из атомов сильно отличается от электроотрицательности другого. Это приводит к неравному распределению электронной плотности в связующей молекуле и возникновению диполя.
Примером полярной связи может служить связь между водородом и кислородом в молекуле воды (H2O). В этом случае кислород является более электроотрицательным атомом, чем водород, поэтому захватывает доля электронной плотности в молекуле. В результате образуется полярная связь между кислородом и водородом с частичным отрицательным зарядом на кислороде и частичным положительным зарядом на водороде.
Полярная связь обладает свойствами, которые отличают ее от неполярной: полярные молекулы могут образовывать диполи и обладать свойствами растворимости в полярных растворителях. Также полярная связь может вызывать притяжение между молекулами и приводить к образованию межмолекулярных взаимодействий, таких как водородные связи.
Изучение полярной связи
Для изучения полярной связи необходимо определить разницу в электроотрицательностях атомов, включенных в связь. Если эта разница больше или равна 0.5, связь считается полярной. Электроотрицательность элементов можно найти в таблице Менделеева или в специальных справочниках.
Полярная связь имеет ряд особенностей:
- Полярная связь обладает дипольным моментом, так как существует положительно заряженная область и отрицательно заряженная область в молекуле.
- Полярная связь обычно более сильная, чем неполярная связь.
- Полярная связь может создавать водородные связи, что приводит к повышенной точке кипения и плотности вещества.
- Полярная связь может взаимодействовать с другими полярными или ионными соединениями.
Примерами молекул с полярной связью являются вода (H2O) и аммиак (NH3). В обоих случаях разница электроотрицательностей между атомами составляет более 0.5, что приводит к образованию полярной связи.
Примеры полярной связи
Одним из примеров полярной связи является водный молекула, H2O. В этой молекуле кислородный атом, обладающий более высокой электроотрицательностью, притягивает электроны, создавая частичный отрицательный заряд на себе. Водородные атомы, напротив, обладают частичным положительным зарядом.
Другим примером полярной связи является молекула аммиака, NH3. В этой молекуле азотный атом, обладающий более высокой электроотрицательностью, притягивает электроны от водородных атомов, создавая частичный отрицательный заряд. Водородные атомы, в свою очередь, имеют частичный положительный заряд.
Полярные связи также могут образовываться между различными атомами, например, между серой (S) и кислородом (O) в молекуле диоксида серы (SO2).
Неполярная связь: что это и как она отличается от ковалентной и полярной
Одной из главных особенностей неполярной связи является равное распределение электронной плотности между атомами. Это означает, что оба атома имеют одинаковую долю электронов в связи и не обладают зарядом.
Несмотря на отсутствие разности электроотрицательности, неполярная связь все еще обладает устойчивостью и способностью существовать в химических соединениях, таких как молекулы, и кристаллических структурах.
| Тип связи | Отличительные черты | Примеры веществ |
|---|---|---|
| Неполярная связь | Равное распределение электронной плотности, отсутствие разности электроотрицательности | Молекула йода (I2), молекула бензола (C6H6) |
| Ковалентная связь | Общие пары электронов между атомами | Молекула воды (H2O), молекула аммиака (NH3) |
| Полярная связь | Неравное распределение электронной плотности, наличие разности электроотрицательности | Молекула HF, молекула HCl |
Неполярная связь имеет значительное значение в области химии и химической связи. Она позволяет атомам объединяться в структуры и образовывать молекулы с уникальными физическими и химическими свойствами.
Важно отметить, что химические связи между атомами вещества могут быть комбинацией неполярных, полярных и ковалентных связей, что способствует разнообразию возможных соединений и свойств веществ.
Изучение неполярной связи
В неполярной связи электроны общие для обоих атомов распределяются равномерно между ними. Это происходит, когда два атома имеют одинаковую или схожую электроотрицательность, и их общие электроны находятся в равновесии между ними.
Неполярная связь является сильной и стабильной, поэтому такие молекулы обычно имеют низкую температуру кипения и плавления. Примерами веществ с неполярными связями могут служить молекулы газов, таких как кислород (O2), азот (N2), и хлор (Cl2).
Неполярная связь играет важную роль в органической химии, так как большинство органических молекул содержат неполярные связи. Например, молекулы углеводородов (такие как метан, этилен, пропан) и алканы (этанол, метанол) содержат только неполярные связи.








