В химии расставление коэффициентов – это важная задача, которая требует точности и аккуратности. Коэффициенты в химических уравнениях показывают, сколько атомов или молекул каждого вещества участвует в реакции. Правильная расстановка коэффициентов позволяет соблюсти законы сохранения массы и энергии, важные принципы в химии.
Также расставление коэффициентов в химии позволяет балансировать химические уравнения. Балансировка – это процесс, при котором число атомов каждого элемента в реакции остается неизменным до и после реакции. Без балансировки равенство не будет соблюдаться. Для расстановки коэффициентов в химическом уравнении необходимо использовать определенные методы и принципы.
Один из основных принципов расстановки коэффициентов в химии – это принцип сохранения массы. Согласно этому принципу, общая масса реагентов в начале реакции должна быть равна общей массе продуктов после реакции. Для его соблюдения необходимо подобрать такие коэффициенты, чтобы сумма атомных масс реагентов была равна сумме атомных масс продуктов.
Еще один важный метод расстановки коэффициентов – это метод инспекции. Он основан на опыте и понимании особенностей реакции. При помощи метода инспекции можно выявить простые и очевидные соотношения между атомами или молекулами веществ, что помогает правильно расставить коэффициенты.
Таким образом, расстановка коэффициентов в химии – это важная задача, которая позволяет соблюсти законы сохранения массы и энергии в химических реакциях. С использованием принципа сохранения массы и метода инспекции можно правильно расставить коэффициенты и балансировать химические уравнения.
Важность расставления коэффициентов в химических уравнениях
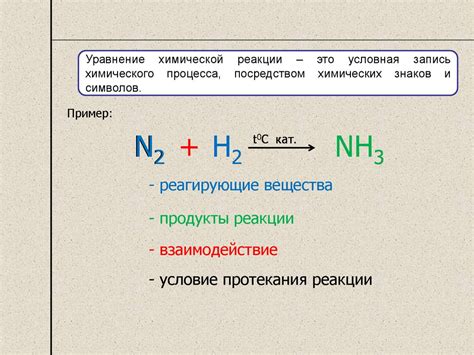
Расставление коэффициентов в химических уравнениях позволяет достичь массовой и атомной равновесности в реакции. Без правильного распределения коэффициентов, уравнение будет неправильным и не будет отражать реальные пропорции между реагентами и продуктами.
Кроме того, расставление коэффициентов имеет практическую значимость. Во-первых, это позволяет определить необходимое количество реагентов для проведения химической реакции. Во-вторых, расчеты с использованием коэффициентов позволяют рассчитать количество получаемых продуктов или реагентов после реакции. Это невероятно важно для проведения экспериментов и разработки новых химических процессов.
Таким образом, правильное распределение коэффициентов является основой химических уравнений и позволяет провести анализ химических реакций с точностью и достоверностью.
Принципы расстановки коэффициентов
Расстановка коэффициентов основана на нескольких принципах:
- Закон сохранения массы. Согласно этому закону, масса реагентов должна быть равна массе продуктов реакции. Поэтому сумма коэффициентов перед реагентами должна быть равна сумме коэффициентов перед продуктами.
- Закон сохранения заряда. В реакции должно быть сохранено общее количество положительных и отрицательных зарядов. Это означает, что сумма зарядов реагентов должна быть равна сумме зарядов продуктов.
- Наименьший общий делитель. Расстановка коэффициентов должна осуществляться таким образом, чтобы наименьший общий делитель всех коэффициентов был равен 1. Это позволяет представить уравнение в наиболее простой и удобной форме.
- Целые числа. Коэффициенты в химических уравнениях должны быть целыми числами, так как они указывают на соотношение между молекулами или атомами веществ.
Для расстановки коэффициентов в уравнении обычно используют пробный и ошибочный метод. В этом методе, начиная с вещества, которое входит в реакцию в наименьшем количестве, рассчитывают количество атомов каждого элемента на стороне реакции. Затем расстановка коэффициентов ведется таким образом, чтобы привести количество атомов каждого элемента на стороне реакции к пропорциональным значениям.
Соотношение масс веществ в химическом уравнении

Для правильного расчета массы веществ, участвующих в реакции, необходимо использовать коэффициенты стехиометрического уравнения. Эти коэффициенты показывают, в каком соотношении вещества реагируют и образуют продукты. Они могут быть целыми числами и обычно записываются перед формулами веществ.
Коэффициенты стехиометрического уравнения также описывают соотношение масс веществ. Например, если в уравнении реакции перед формулой вещества стоит коэффициент "2", это означает, что для реакции используется два моля этого вещества. Таким образом, масса этого вещества будет в два раза больше, чем его молярная масса.
Для расчета массы веществ в химическом уравнении можно использовать таблицу молярных масс элементов. Зная молярную массу каждого элемента, можно найти массу вещества, используя его количество в уравнении. При расчетах также необходимо учитывать, что масса реакционных веществ должна быть равна массе образовавшихся продуктов.
| Вещество | Молекулярная масса (г/моль) | Коэффициенты | Масса (г) |
|---|---|---|---|
| Вещество 1 | Масса 1 | Коэффициент 1 | Масса 1 * Коэффициент 1 |
| Вещество 2 | Масса 2 | Коэффициент 2 | Масса 2 * Коэффициент 2 |
| Продукты реакции | Масса продукта 1 | Коэффициент продукта 1 | Масса продукта 1 * Коэффициент продукта 1 |
| Продукты реакции | Масса продукта 2 | Коэффициент продукта 2 | Масса продукта 2 * Коэффициент продукта 2 |
Важно не забывать, что массы веществ должны сохраняться в химической реакции. То есть, сумма масс реагентов должна быть равной сумме масс продуктов. Если это условие не выполняется, то уравнение не корректно и требует корректировки коэффициентов.
Закон сохранения массы
Этот закон был формулирован в 18 веке французским химиком Антуаном Лавуазье и является одним из фундаментальных принципов химии. Он основывается на принципе сохранения энергии и массы, согласно которому в системе, изолированной от внешних факторов, общая масса остается неизменной во всех физических и химических процессах.
Закон сохранения массы можно выразить математически с помощью химических уравнений. В химическом уравнении каждое вещество обозначается формулой, а коэффициент перед формулой указывает, в каком соотношении происходит реакция между веществами. При этом сумма коэффициентов перед реагентами должна быть равна сумме коэффициентов перед продуктами реакции.
Соблюдение закона сохранения массы является важным при проведении химических расчетов и экспериментов. Изменение массы в процессе реакции может свидетельствовать о процессах образования или разрушения веществ, а также о присутствии или отсутствии реакции в системе.
Методы расстановки коэффициентов
Существуют различные методы для расстановки коэффициентов в химических уравнениях:
| Метод | Описание |
|---|---|
| Метод инспекции | Этот метод используется для простых химических уравнений, где можно просто с помощью инспекции подобрать подходящие коэффициенты. |
| Метод степеней окисления | Этот метод основан на определении и расчете степеней окисления элементов веществ и их изменении при химических превращениях. |
| Метод баланса | Этот метод базируется на принципе сохранения массы и энергии. Он заключается в установлении равенства количества атомов каждого элемента на обеих сторонах химического уравнения. |
| Метод полуравностей | Этот метод используется для расстановки коэффициентов при окислительно-восстановительных реакциях. Он заключается в разделении реакции на окислительные и восстановительные полуравнения, и последующем сбалансировании их. |
Каждый из этих методов имеет свои особенности и применяется в зависимости от сложности и типа химического уравнения. Расставление коэффициентов требует внимательного анализа и математических расчетов для достижения корректного результат.
Метод инспекции
Принцип метода инспекции заключается в том, что сумма атомов каждого элемента на левой стороне уравнения должна быть равна сумме атомов этого элемента на правой стороне уравнения.
Для применения метода инспекции необходимо провести следующие шаги:
- Записать химическое уравнение.
- Начать с наибольшего количества атомов элементов, которые присутствуют в уравнении. Обычно начинают с вещества, содержащего наибольшую число атомов, и продолжают с остальных элементов по убыванию.
- Обозначить неизвестные коэффициенты переменными и записать соответствующие выражения для количества атомов каждого элемента до и после реакции.
- Составить систему уравнений и решить ее, чтобы найти значения коэффициентов.
- Проверить полученное решение, убедившись, что сумма атомов каждого элемента на левой и правой стороне уравнения совпадает.
Метод инспекции позволяет быстро и эффективно расставить коэффициенты в химическом уравнении, однако он требует некоторой тренировки и опыта для правильного применения.
Метод проб и ошибок

Основная идея метода проб и ошибок заключается в том, что мы начинаем с уравнения, в котором все коэффициенты равны единице, и постепенно изменяем их значения, чтобы достичь баланса между реагентами и продуктами. После каждого изменения коэффициентов мы проверяем, что сумма элементов на левой стороне уравнения равна сумме элементов на правой стороне.
Процесс проб и ошибок требует тщательного анализа и численных расчетов. Важно учесть, что мы должны работать только с целыми числами в коэффициентах, так как они определяют молекулярное соотношение веществ. Также необходимо учесть заряды и балансировку ионов в уравнении.
Метод проб и ошибок часто применяется в ситуациях, когда нет явной формулы для расстановки коэффициентов или когда уравнение содержит сложные соединения. Также этот метод может быть полезен для расстановки коэффициентов в соединениях с переменной валентностью.
Хотя метод проб и ошибок является неточным и трудоемким, он может быть эффективным при правильном подходе. В химии, как и в любой науке, важно практиковать и экспериментировать, чтобы найти оптимальные решения и достичь желаемых результатов.
| Пример | Исходное уравнение | Результат |
|---|---|---|
| 1 | H2 + O2 -> H2O | 2H2 + O2 -> 2H2O |
| 2 | Fe + O2 -> Fe2O3 | 4Fe + 3O2 -> 2Fe2O3 |
| 3 | KMnO4 + HCl -> KCl + MnCl2 + H2O + Cl2 | 2KMnO4 + 16HCl -> 2KCl + 2MnCl2 + 8H2O + 5Cl2 |
Метод баланса
Для использования метода баланса необходимо следующее:
- Записать химическое уравнение с неизвестными коэффициентами.
- Расставить перед каждым веществом в уравнении коэффициенты.
- Составить систему линейных уравнений, в которой каждое уравнение соответствует закону сохранения массы для одного из элементов.
- Решить систему уравнений, найдя значения коэффициентов.
- Проверить полученный результат, уравняв уравнение и убедившись, что сумма масс каждого элемента находится в равновесии.
Преимуществом метода баланса является то, что он позволяет найти коэффициенты в уравнении, подчиняющиеся закону сохранения массы. Однако, этот метод может быть трудоемким и требовать некоторого опыта и навыков.
В целом, метод баланса является важным инструментом в химии и широко используется для расстановки коэффициентов в химических уравнениях, позволяя установить соответствие между стехиометрией сырья и продуктов реакции.








