Химическая связь - это одно из основных понятий химии, которое определяет способ взаимодействия атомов в химических соединениях. Понимание типа химической связи между атомами является важным шагом для понимания химических реакций и свойств веществ.
Существует несколько типов химической связи, которые могут образовываться между атомами: ионная, ковалентная и металлическая связи. Каждый тип связи имеет свои особенности и характеристики, которые можно определить с помощью различных методов и правил.
Определение типа химической связи может быть основано на электроотрицательности атомов, их способности принимать или отдавать электроны, а также их расположении в периодической таблице. Кроме того, некоторые свойства веществ, такие как температура плавления и кипения, могут также указывать на тип связи.
В данной статье мы рассмотрим подробное объяснение каждого типа химической связи и методы их определения. Мы также рассмотрим примеры применения этих методов на конкретных веществах, чтобы помочь вам разобраться в этой сложной теме более детально.
Как узнать химическую связь: подробное объяснение
Определение типа химической связи осуществляется на основе ряда физических и химических свойств вещества. Вот несколько способов, которые позволяют узнать, какой тип химической связи присутствует в молекуле или ионе:
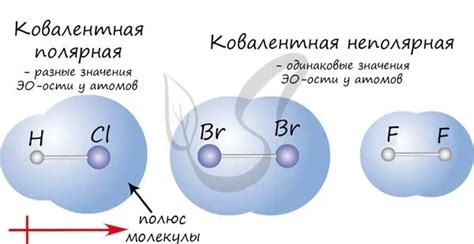
- Расчет электроотрицательности: химическая связь может быть ионной, ковалентной или полярной ковалентной в зависимости от разницы в электроотрицательности атомов, образующих связь. Если разница электроотрицательности равна 0, связь является неметаллической и ковалентной. Если разница электроотрицательности больше 1,7, связь является ионной.
- Анализ геометрии молекулы: по геометрии молекулы или иона можно судить о типе химической связи. Например, если все атомы в молекуле разделены и соединены с помощью одинарных ковалентных связей, связь является ковалентной. Если имеются двойные или тройные ковалентные связи, это может указывать на наличие полярной ковалентной связи.
- Использование химических свойств: различные химические свойства вещества могут указывать на наличие определенного типа химической связи. Например, если вещество проводит электрический ток в расплавленном или растворенном состоянии, то это говорит о наличии ионной связи.
- Анализ фазы вещества: тип химической связи может также определяться фазой вещества. Например, вещества, которые находятся в газообразном состоянии при комнатной температуре, обычно имеют ковалентную связь, в то время как вещества, находящиеся в твердом состоянии, могут содержать ионную связь.
Важно отметить, что многие соединения содержат смешанные типы химической связи, что может усложнить их определение. Кроме того, химическая связь может меняться в зависимости от условий, в которых находится вещество.
В целом, определение типа химической связи требует комплексного подхода, включающего в себя анализ различных факторов и свойств вещества.
Основные типы
Существуют три основных типа химической связи: ионная, ковалентная и металлическая.
Ионная связь образуется между атомами, когда один атом отдает электроны, а другой атом их принимает. В результате образуются ионы с противоположными зарядами, которые притягиваются друг к другу и образуют кристаллическую структуру.
Ковалентная связь возникает, когда два атома делят пару электронов. Образуется общая электронная пара, которая связывает атомы в молекулу. Ковалентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов.
Металлическая связь формируется в металлах, где электроны мигрируют свободно между атомами. В результате образуется сеть положительно заряженных ядер и свободных электронов, которые создают металлическую структуру и обеспечивают свойства металлов, такие как проводимость электричества и тепла.
Каждый из этих типов связей имеет свои особенности и влияет на химические и физические свойства вещества.
Ковалентная связь
Ковалентная связь образуется, когда два атома совместно используют пару электронов, чтобы создать соединение. Пара электронов, которые общаются между атомами и образуют ковалентную связь, называется электронной парой.
Ковалентная связь может быть одиночной, двойной или тройной, в зависимости от количества электронных пар, разделяющихся между атомами. В одиночной ковалентной связи атомы обменивают одну электронную пару, в двойной - две электронные пары, а в тройной - три электронные пары.
Ковалентная связь является очень сильной и плотной связью между атомами, что делает ее основой для образования многих химических соединений. Некоторые примеры включают воду (H2O), кислород (O2) и метан (CH4).
Ионная связь
В ионной связи между ионами с противоположными зарядами действует электростатическое притяжение. Обычно ионная связь формируется между металлами и неметаллами. Металлы имеют склонность терять электроны, образуя положительно заряженные ионы, называемые катионами. Неметаллы, напротив, имеют склонность получать электроны, образуя отрицательно заряженные ионы, называемые анионами.
Ионная связь обладает высокой прочностью, что делает ионные соединения твёрдыми и хрупкими веществами с высокими температурами плавления и кипения. Примерами ионных соединений являются хлорид натрия (NaCl), сульфат магния (MgSO4) и оксид алюминия (Al2O3).
Металлическая связь

В металлической связи катионы и электроны образуют общую область энергии - зону проводимости. Электроны могут свободно передвигаться по этой зоне, образуя так называемый "море электронов". В результате образуется сильная связь между металлическими ионами.
Металлическая связь обладает рядом особенностей:
- Металлы отличаются высокой электропроводностью благодаря свободному движению электронов в решетке.
- Металлическая связь обычно является не полярной, поскольку электроны свободно передвигаются во всей решетке.
- Металлы обладают хорошей теплопроводностью, так как электроны эффективно переносят тепло в решетке.
- Металлическая связь позволяет металлам образовывать проводимую поверхность, что является основой для электрических проводников.
- Металлы часто образуют сплавы, что объясняется возможностью образования сильных связей между разными металлическими ионами.
Примерами веществ с металлической связью являются металлы, такие как железо, алюминий, медь и золото.
Как определить тип связи
1. Анализ электроотрицательностей. Электроотрицательность атомов вещественных элементов может помочь определить тип связи. Если разница в электроотрицательности между атомами большая (более 1.9), это указывает на ионную связь. Если разница небольшая (менее 1.9), это может указывать на полярную ковалентную связь. Если разница незначительна, это может указывать на неполярную ковалентную связь.
2. Расположение электронов. Смотрите на расположение электронов в атомах. Если электроны между атомами расположены равномерно и симметрично, это указывает на неполярную ковалентную связь. Если электроны расположены неравномерно, это может указывать на полярную ковалентную связь. Если электроны отсутствуют, это может указывать на ионную связь.
3. Свойства соединения. Изучите физические свойства соединения. Если соединение имеет высокую температуру плавления и кипения, а также является хорошим проводником электричества, это может указывать на ионную связь. Если соединение имеет более низкую температуру плавления и кипения, и не проводит электричество, это может указывать на ковалентную связь.
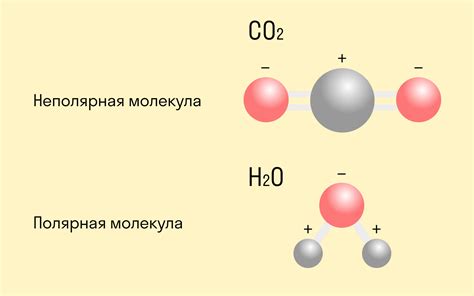
4. Анализ молекулярной структуры. Рассмотрите форму молекулы и ее строение. Если молекула имеет линейную или симметричную структуру, это может указывать на неполярную ковалентную связь. Если молекула имеет искривленную или несимметричную форму, это может указывать на полярную ковалентную связь.
Примечание: все эти методы предоставляют только предположения о типе связи и могут быть использованы вместе для достижения более точных результатов.
Факторы, влияющие на тип связи

2. Размер атомов. Размер атомов также влияет на тип химической связи. Если размеры атомов значительно различаются, то образуется ионная связь. Если размеры атомов близки друг к другу, то образуется ковалентная связь.
3. Заряд ионов. Заряд ионов также влияет на тип химической связи. Если ион имеет положительный заряд, то образуется катионная связь. Если ион имеет отрицательный заряд, то образуется анионная связь.
4. Валентность элементов. Валентность элементов указывает на количество связей, которое атом может образовать. Если валентность элемента равна или меньше количества свободных валентных электронов, то образуется ковалентная связь. Если валентность элемента больше количества свободных валентных электронов, то образуется ионная связь.
5. Формальный заряд. Формальный заряд атома указывает на количество электронов, потерянных или приобретенных атомом при образовании связи. Если формальный заряд равен нулю, то образуется ковалентная связь. Если формальный заряд не равен нулю, то образуется ионная связь.
6. Количество и расположение связей. Количество и расположение связей также влияют на тип химической связи. Если атом образует одну связь, то это может быть либо ионная, либо ковалентная связь. Если атом образует несколько связей, то это может быть только ковалентная связь.
7. Сила связи. Сила связи зависит от типа химической связи и может варьироваться. Ионные связи обычно более прочные, чем ковалентные связи. Ковалентные связи могут быть одновременно полярными и неполярными.
Важно учитывать, что эти факторы могут взаимодействовать и влиять друг на друга, поэтому определение типа химической связи может быть комплексным заданием.
Примеры веществ с разными типами связей
В химии существует несколько типов химических связей, каждый из которых характеризуется определенными силами, длиной и ориентацией электронных облаков. Ниже приведены примеры веществ с разными типами связей:
- Ионные связи: вещества, содержащие ионы, образуют ионную связь. Примерами могут служить хлорид натрия (NaCl) и сульфат магния (MgSO4).
- Ковалентные связи: вещества, в которых атомы образуют пары электронов, образуют ковалентные связи. Примерами являются вода (H2O) и углекислый газ (CO2).
- Металлические связи: вещества, состоящие из металлов, образуют металлические связи. Примерами могут служить железо (Fe) и медь (Cu).
- Водородные связи: водородные связи образуются между водородом и электроотрицательными атомами. Примером может служить молекула воды (H2O).
- Ван-дер-ваальсовы связи: слабые электростатические силы, действующие между неэлектрическими атомами и молекулами, называются ван-дер-ваальсовыми связями. Примерами могут служить инертные газы, такие как гелий (He) и неон (Ne).
Это лишь некоторые примеры веществ с разными типами химических связей. В реальности существует множество различных соединений с уникальными свойствами и типами связей.








