Электроны внешнего слоя - одни из ключевых частиц атома, которые играют важную роль в химических реакциях и формировании химических соединений. В атоме электроны располагаются на разных энергетических уровнях, и электроны внешнего слоя имеют наибольший потенциал для взаимодействия с другими атомами.
Основное понятие, связанное с электронами внешнего слоя - валентность. Валентность обозначает количество электронов внешнего слоя атома, которые могут участвовать в химических реакциях. Она определяет активность атома при образовании химических связей и его способность образовывать стабильные соединения с другими атомами.
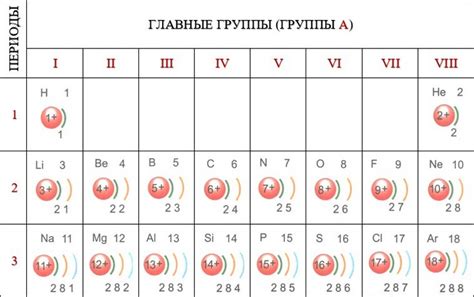
Примером значимости электронов внешнего слоя является реакция образования хлорида натрия. Натрий имеет атомный номер 11 и конфигурацию электронов 2, 8, 1. Это означает, что внешним слоем натрия является один электрон. Хлор, с атомным номером 17 и конфигурацией электронов 2, 8, 7, также имеет семь электронов внешнего слоя.
При реакции образования хлорида натрия, электрон из внешнего слоя натрия передается внешнему слою хлора, образуя ион Na^+ и ион Cl^- в форме хлорида натрия. Это происходит из-за того, что натрий желает избавиться от своего единственного электрона внешнего слоя, в то время как хлор нуждается в одном электроне для заполнения своего внешнего слоя.
Таким образом, значимость электронов внешнего слоя состоит в их способности участвовать в образовании химических связей и реакций, а также в формировании стабильных химических соединений.
Внешний слой электронов: определение и значение
Атомы стремятся достичь электронной конфигурации инертных газов, в которой внешний электронный слой заполнен полностью. Для этого атомы могут образовывать химические связи с другими атомами или уступать/получать электроны.
Важную роль в химических реакциях играют валентные электроны, находящиеся во внешнем слое атома. Они могут образовывать связи с другими атомами, обменяться или передать электроны, что определяет химические свойства вещества.
Например, кислород имеет 6 электронов во внешнем электронном слое. Чтобы достичь стабильности, он может принять 2 электрона от других атомов, образуя две ковалентные связи. Атом натрия, наоборот, имеет один электрон во внешнем слое, и он может отдать этот электрон другому атому, чтобы достичь стабильности. Это делает натрий электроотрицательным и способным образовывать ионы.
Понимание значения электронов внешнего слоя является важным для объяснения и предсказания химических свойств веществ и процессов, происходящих при химических реакциях.
Электроны: основные элементы атома
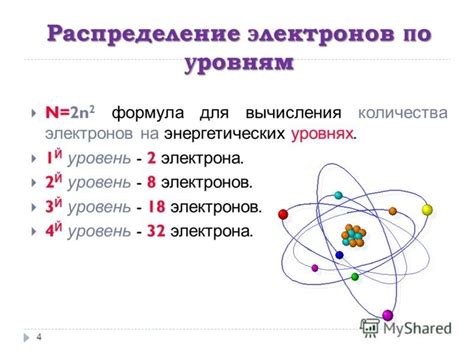
Электроны находятся вокруг ядра атома и образуют электронные оболочки. Каждая оболочка может содержать определенное количество электронов. Внешняя оболочка называется валентной, именно в ней располагаются электроны внешнего слоя.
Количество электронов в валентной оболочке влияет на химические свойства вещества. Валентные электроны могут участвовать в химических реакциях, образуя химические связи с другими атомами, и определять степень реакционной способности вещества. Например, у атома кислорода валентной оболочкой являются шесть электронов, что определяет его высокую реакционную способность.
Электроны внешнего слоя также играют важную роль в электронной структуре атома. Число электронов внешнего слоя может варьироваться в зависимости от количества оболочек в атоме.
Какие свойства определяются электронами внешнего слоя?

Электроны в внешнем слое атома определяют ряд важных свойств, которые играют ключевую роль в химических реакциях и связях между атомами:
| 1. Валентность | Количество электронов в внешнем слое атома называется валентностью. Она определяет способность атома образовывать химические связи с другими атомами и участвовать в химических реакциях. |
| 2. Химические связи | Электроны внешнего слоя играют роль в формировании химических связей между атомами. Они могут быть переданы, разделены или взяты из другого атома, что позволяет образовывать различные типы химических связей, например, ионные или ковалентные. |
| 3. Реакционная способность | Свободные электроны в непарных орбиталях внешнего слоя делают атом химически активным и способным образовывать химические связи. Они могут реагировать с другими атомами или ионами, чтобы образовывать молекулы или соединения. |
| 4. Электроотрицательность | Электроотрицательность атома определяет его способность притягивать электроны в химической связи. Эта способность зависит от количества электронов в внешнем слое. Атомы с большим количеством электронов в внешнем слое обычно обладают большей электроотрицательностью. |
Электроны внешнего слоя играют важную роль в понимании и объяснении химических свойств и поведения атомов и молекул. Понимание этих свойств помогает в изучении химических реакций, создании новых соединений и материалов, и развитии различных областей науки и технологий.
Роль электронов внешнего слоя при химических реакциях
Электроны внешнего слоя атома играют важную роль при химических реакциях. Они определяют взаимодействия атомов и молекул, образуя химические связи.
Внешний слой электронов называется валентным слоем. В этом слое находятся электроны, которые наиболее доступны для участия в химических реакциях. Они могут совместно образовывать связи с другими атомами, образуя структуру молекулы.
Электроны валентного слоя могут быть переданы или приняты другими атомами во время химической реакции. Этот процесс называется образованием химической связи. При передаче электронов одного атома другому, образуются ионы разного заряда. Если электроны равномерно распределены между атомами, образуются молекулярные связи.
Например, водород и кислород могут образовывать химическую связь, образуя молекулу воды. Атом кислорода принимает два электрона от двух атомов водорода, образуя отрицательно заряженные ионы кислорода и положительно заряженные ионы водорода. Таким образом образуется водная молекула, где электроны валентного слоя кислорода формируют молекулярные связи с водородом.
| Вещество | Валентное число |
|---|---|
| Водород (H) | 1 |
| Кислород (O) | 2 |
| Углерод (C) | 4 |
| Азот (N) | 3 |
Валентные числа отражают количество связей, которые атом может образовать. Например, атом кислорода может образовать две связи, поэтому его валентное число равно 2. Подобным образом, валентное число указывает на количество электронов внешнего слоя атома.
Электроны внешнего слоя являются ключевыми игроками во многих химических реакциях, таких как окисление, восстановление, прямые и обратные реакции. Понимание и контроль над ролью этих электронов помогает ученым и инженерам разрабатывать новые вещества, материалы и применения для улучшения нашей жизни и окружающей среды.
Значение электронов внешнего слоя в кристаллографии
В кристаллографии электроны внешнего слоя играют важную роль в определении химических и физических свойств кристаллических материалов. Возможность обмена электронами между атомами в кристаллической решетке позволяет кристаллам обладать уникальными свойствами, такими как электропроводность и оптические свойства.
Основной параметр, определяющий химическую активность и реакционную способность атома, это количество электронов в его внешнем энергетическом уровне. Внешний энергетический уровень атома определяется его порядковым номером в периодической системе элементов.
Элементы, у которых внешний энергетический уровень содержит полный комплект электронов, называются инертными или неподвижными газами. Например, гелий, неон и аргон имеют заполненный внешний энергетический уровень, и поэтому они обладают малой химической активностью.
Элементы, у которых внешний энергетический уровень не полностью заполнен, называются активными элементами. Например, элементы первой группы периодической системы - литий, натрий, калий и др., имеют один электрон в внешнем энергетическом уровне, и поэтому они химически активны и легко вступают в реакции соединения.
Электроны внешнего слоя также играют важную роль в формировании связей между атомами в кристаллической решетке. Электроны могут образовывать ковалентные связи, валентные связи или ионные связи, в зависимости от их взаимодействия с другими атомами.
В итоге, понимание значения электронов внешнего слоя в кристаллографии позволяет углубить наши знания о химических и физических свойствах кристаллических материалов и использовать эту информацию для создания новых материалов с желаемыми свойствами.
Ионизация электронов внешнего слоя: что это такое?
Внешний электронный слой атома содержит электроны, которые находятся на наиболее дальних от ядра энергетических уровнях. Эти электроны отвечают за химические свойства атома и определяют его реакционную способность.
Во время ионизации электронов могут совершать переходы между энергетическими уровнями под влиянием различных факторов, например, при взаимодействии с электромагнитным излучением, атомами или ионами других веществ, или при попадании в электрическое поле.
Ионизация может приводить к образованию положительных или отрицательных ионов. При потере электрона атом становится положительно заряженным ионом, а при приобретении дополнительного электрона - отрицательно заряженным ионом.
Примеры ионизации электронов внешнего слоя:
- Водородный атом (H) может потерять свой единственный внешний электрон, став положительно заряженным ионом H+, или приобрести ещё один электрон, став отрицательно заряженным ионом H-.
- Магниевый атом (Mg) имеет два электрона во внешнем слое и может потерять оба электрона, став положительно заряженным ионом Mg2+.
- Хлоровый атом (Cl) имеет семь электронов во внешнем слое и может приобрести ещё один электрон, став отрицательно заряженным ионом Cl-.
Примеры элементов с электронами внешнего слоя
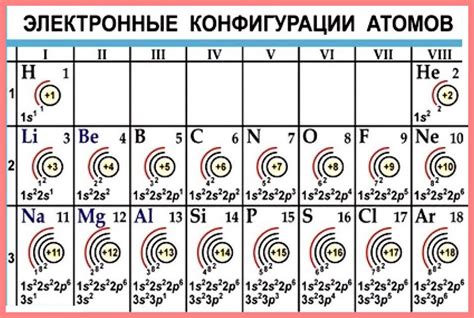
Элементы, в которых электроны внешнего слоя играют важную роль, включают:
- Литий (Li) - имеет 3 электрона внешнего слоя, что делает его реактивным и готовым образовать ион Li+;
- Кислород (O) - имеет 6 электронов внешнего слоя, что делает его стремительно реактивным и готовым образовать соединения с другими элементами;
- Хлор (Cl) - имеет 7 электронов внешнего слоя, что делает его готовым образовать ион Cl- и выполнять функции с ионами металлов;
- Криптон (Kr) - имеет 8 электронов внешнего слоя, что делает его инертным и предотвращает его реактивность с другими элементами;
- Флуор (F) - имеет 7 электронов внешнего слоя и является самым реактивным элементом;
- Натрий (Na) - имеет 1 электрон внешнего слоя и может легко отдать его, образуя ион Na+;
- Неон (Ne) - имеет 8 электронов внешнего слоя, что делает его инертным и неформирующим химические соединения.
Внешний слой и электроны-валентность
Электроны в внешнем слое атома, также известные как валентные электроны, играют важную роль в химических реакциях и связывают атомы между собой. Они определяют свойства атома и его способность участвовать в химических реакциях.
Валентность – это количество электронов во внешнем слое атома. Все элементы стремятся заполнить свои внешние слои электронами, чтобы достичь наиболее стабильного энергетического состояния – октета, то есть иметь 8 электронов во внешнем слое (за исключением некоторых элементов, для которых октет расширяется до 18 электронов).
Например, у атома кислорода есть 6 электронов в его внешнем слое, так что он нуждается в двух дополнительных электронах, чтобы достичь октета. Поэтому он обладает валентностью 2 (O-2). Натрий имеет один электрон во внешнем слое, поэтому его валентность составляет 1 (Na+).
Электроны-валентность определяют способность атомов образовывать химические связи. Атомы, имеющие неполный внешний слой, стремятся получить или отдать электроны, чтобы достичь стабильного состояния октета. Соединения образуются путем обмена, передачи или совместного использования электронов между атомами.
Значение электронов внешнего слоя в проводимости веществ

Электроны внешнего энергетического уровня атомов веществ могут играть важную роль в их проводимости. Внешний слой электронов, также называемый валентной оболочкой, содержит свободные электроны, которые отвечают за электрическую проводимость двух типов веществ: металлов и наполненных полупроводников.
Металлы обладают высокой проводимостью, поскольку в их валентной оболочке находятся мало или вообще нет свободных электронов. Это позволяет электронам перемещаться с одной атомной структуры на другую, создавая электрическую проводимость. Кроме того, электроны внешнего слоя металлов способны легко двигаться под воздействием внешнего электрического поля, что обуславливает их высокую электропроводность.
Наполненные полупроводники имеют промежуточные показатели проводимости между металлами и диэлектриками. В их валентной оболочке есть некоторое количество свободных электронов, способствующих проводимости. Однако эта проводимость намного ниже, чем у металлов, поскольку электроны в полупроводниках могут передвигаться не так свободно.
Таким образом, электроны внешнего слоя играют важную роль в проводимости веществ. Их наличие и способность перемещаться придают материалам свойства проводников или полупроводников, что важно и находит применение в различных областях науки и техники.
Значение электронов внешнего слоя для определения химической активности вещества
Электроны внешнего слоя атома играют важную роль в определении химической активности вещества. Внешний слой электронов, также известный как валентная оболочка, состоит из электронов, которые находятся на самом большом энергетическом уровне атома.
Количество электронов внешнего слоя определяет, насколько атом будет готов образовывать химические связи с другими атомами. Если внешний слой атома содержит неполный четырех или восьми электронов, атом будет стремиться либо принять электроны, чтобы заполнить внешний слой, либо отдать лишние электроны, чтобы создать полный внешний слой. Это стремление атомов заполнить или опустошить внешний слой называется правилом октета.
Примером этого являются атомы в группе 1 и 2 периодической системы, такие как натрий и калий, которые имеют один или два электрона в внешнем слое соответственно. Они легко отдают эти электроны, чтобы стать положительно заряженными ионами. В группе 7 и 8, например, хлор и аргон имеют семь и восемь электронов в внешнем слое, соответственно. Они легко принимают электроны, чтобы стать отрицательно заряженными ионами.
Понимание значения электронов внешнего слоя помогает в объяснении химических реакций и свойств веществ. Оно также помогает в создании моделей взаимодействия между атомами и прогнозировании, какие вещества будут обладать схожими свойствами и как они будут взаимодействовать друг с другом.








