В химии существует понятие "электронные пары", которое играет важную роль в понимании структуры молекул и химических реакций. Электроны являются основными частицами атома, и их расположение вокруг ядра определяет свойства и поведение атома. В некоторых случаях электроны могут образовывать особую структуру, называемую электронной парой.
Электронная пара представляет собой пару электронов, которая образуется, когда два атома делят между собой электроны во внешней оболочке. Обычно электронная пара находится между двумя атомами, связанными химической связью. Важно отметить, что электронные пары могут быть различных типов - одиночные, двойные или тройные, в зависимости от количества электронов, образующих пару.
Электронные пары в химии играют важную роль в определении формы молекулы и ее свойств. Они помогают стабилизировать молекулярную структуру и определяют расстояние и углы между атомами. Также электронные пары могут участвовать в химических реакциях, они могут быть перенесены с одной молекулы на другую, образуя новые связи или разрывая старые.
Понимание электронных пар важно для понимания различных явлений и процессов в химии. Они помогают объяснить, почему молекулы имеют определенную форму, почему некоторые химические реакции происходят быстро, а другие - нет. Изучение электронных пар позволяет углубить понимание химических принципов и открыть новые возможности для создания искусственных материалов или лекарственных препаратов.
Понятие "электронные пары" и их суть
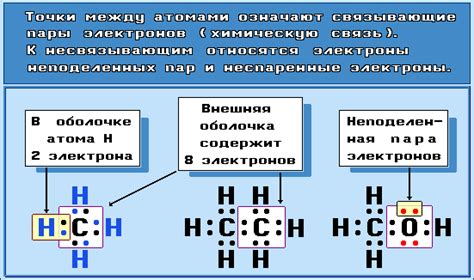
Электронные пары представляют собой пары электронов, которые находятся в общей области пространства, образуя связи между атомами. Они могут быть представлены двумя электронами, которые могут быть разделены на отдельные атомы или находятся в общемоэлектронном облаке в молекуле.
Основной принцип, лежащий в основе электронных пар, является достижение электронами стабильной октетной конфигурации, соответствующей заполненности своих энергетических уровней электронами.
В химической структуре атомов электронные пары могут использоваться для образования химических связей между атомами, притягивая их друг к другу в молекуле. Различные типы связей - одинарные, двойные или тройные - могут быть образованы путем совместного использования электронных пар.
Учитывая свою важность для определения структуры и свойств молекул, понимание электронных пар является фундаментальным для изучения химии и может быть применено для объяснения многих химических процессов.
| Пример | Электронные пары | Описание |
|---|---|---|
| Вода | 2 электронные пары | Кислород образует две одинарные связи с водородом, используя электронные пары для привлечения атомов. |
| Аммиак | 1 электронная пара | Азот образует три одинарные связи с водородом, одну из которых образует с электронной парой. |
| Карбонат ион | 2 электронные пары | Углерод образует две одинарные связи с кислородом, используя электронные пары для привлечения атомов. |
Функции электронных пар в химии
1. Образование химических связей
Электронные пары используются для образования химических связей между атомами. В процессе химической реакции одна или несколько электронных пар переносятся от одного атома к другому, образуя ковалентные связи.
2. Определение геометрии молекулы
Электронные пары влияют на геометрию молекулы. Они отталкиваются друг от друга и стараются занять как можно более удаленные положения, чтобы уменьшить электростатическое отталкивание. Это определяет углы и трехмерную структуру молекул.
3. Определение полярности молекулы
Электронные пары могут создавать полярные связи, что влияет на полярность молекулы. Неоднородное распределение электронной плотности в молекуле, вызванное наличием электронных пар, делает молекулу полярной.
4. Участие в реакциях
Электронные пары могут быть переданы от одной молекулы к другой в процессе химической реакции, участвуя в обмене электронами или процессе миграции электронов. Это позволяет атомам и молекулам образовывать новые связи и менять свою структуру.
Таким образом, электронные пары играют важную роль в химии, определяя свойства и поведение атомов и молекул.
Как образуются электронные пары в атоме
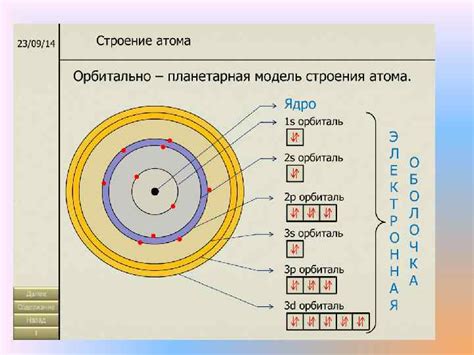
Образование электронных пар в атоме происходит в результате обмена или совместного использования электронов. Атомы стремятся достичь электронной конфигурации инертных газов и образовать стабильные связи между собой. Для этого атомы могут обменять или поделиться своими электронами с другими атомами.
Образование электронной пары при обмене электронами называется ионной связью. В этом случае один атом теряет электроны и становится положительно заряженным ионом (катионом), а другой атом получает электроны и становится отрицательно заряженным ионом (анионом). Катион и анион притягиваются друг к другу электростатической силой и образуют ионную связь.
Если атомы делят электроны между собой, это называется ковалентной связью. В этом случае два атома создают общую электронную пару, которая находится между ними. Электроны в электронной паре принадлежат обоим атомам и притягиваются к ядрам обоих атомов одинаково. В результате образуется ковалентная связь, удерживающая атомы вместе.
Образование электронных пар в атоме зависит от электронной конфигурации атома и его валентной оболочки. Количество электронных пар в атоме определяется числом свободных электронов на валентной оболочке. Атомы стремятся образовать полный набор электронных пар на своей валентной оболочке, чтобы достичь наиболее устойчивого состояния.
Таким образом, образование электронных пар в атоме играет важную роль в образовании связей и определяет химические свойства веществ. Изучение электронных пар помогает понять молекулярную структуру и рационально проектировать новые вещества с заданными свойствами.
Роль электронных пар в образовании химических связей
Электронные пары - это пары электронов, находящихся на внешнем энергетическом уровне атома. Они могут существовать в виде свободных электронных пар или участвовать в образовании химической связи. В процессе образования связи одна из электронных пар атома становится общей - она разделяется двумя атомами, формируя химическую связь.
Общая электронная пара способствует стабилизации образовавшейся молекулы путем создания притяжения между двумя атомами. В результате обмена электронами образуются ковалентные связи, которые являются наиболее распространенными в химии. Ковалентные связи образуются, когда атомы делят пару электронов между собой.
Количество электронных пар, участвующих в образовании химической связи, может быть разным. Например, водородная молекула H2 образуется благодаря общей электронной паре, создавая одну ковалентную связь между двумя атомами водорода. Атомы кислорода воздуха могут образовывать две ковалентные связи между собой, так как каждый атом имеет две электронные пары, которые могут участвовать в образовании связей.
Таким образом, электронные пары являются важным компонентом образования химических связей. Они обеспечивают стабилизацию молекул и определяют химические свойства веществ.
Как электронные пары участвуют в реакциях

Электронные пары, или пары электронов, играют важную роль в химических реакциях, так как они влияют на связи между атомами. Электроны в атомах могут быть разделены на две категории: предельные и непредельные. Предельные электроны располагаются ближе к ядру и основаны на принципе заполнения энергетических уровней. Непредельные электроны, также называемые свободными электронами, представляют собой электроны, которые могут покинуть или принять атом.
В реакциях электронные пары могут образовывать новые связи между атомами. При этом один атом отдает электроны, а другой атом принимает их. Этот процесс называется обменом электронами. Обычно электронные пары образуются в результате наложения на одно и то же атомное или молекулярное орбитальное пространство. Когда пара электронов образуется, они могут стать общей связью между двумя атомами.
Электронные пары могут также быть вовлечены в реакции разрыва связей. В этом случае атом, имеющий электронную пару, может отделить один электрон от партнера, вызывая разрыв связи. Это явление известно как гетеролитическое деление связи и часто происходит в химических реакциях, где образуется ионное соединение.
Важно отметить, что электронные пары обладают отрицательным зарядом, поэтому их вклад в химическую реакцию может варьироваться в зависимости от их наличия и расположения. Электронные пары способствуют стабилизации атомов, образуя связи и изменяя свойства молекулы.
Устройство и свойства электронных пар
Структура электронной пары состоит из двух электронов, находящихся в атомных орбиталях. Один электрон находится в s-орбитали, а другой - в p-орбитали. Электроны в электронной паре имеют противоположные спины, что позволяет им существовать в одной орбитали.
Основные свойства электронных пар:
| Свойство | Описание |
|---|---|
| Поляризация | Электронные пары могут быть поляризованы под влиянием соседних атомов или ионов, что влияет на химические свойства соединения. |
| Пространственная ориентация | Электронные пары имеют определенную пространственную ориентацию вокруг центрального атома, что влияет на структуру молекулы. |
| Сильная атомная связь | Электронные пары создают сильные атомные связи между атомами, что делает молекулу устойчивой. |
Электронные пары обуславливают свойства соединений, такие как геометрия молекулы, тип и сила химической связи, поларность молекулы и т.д. Учитывание электронных пар является ключевым фактором при описании и понимании химических реакций и свойств веществ.
Примеры использования электронных пар в различных химических соединениях
- Водородный катион: в этом случае, водородный атом с одной электронной парой образует положительный ион H+, у которого отсутствует вторая электронная пара.
- Молекулы воды: каждый атом кислорода в молекуле воды имеет две электронные пары, которые ориентированы по форме тетраэдра. Эти пары используются для образования двух химических связей с двумя атомами водорода.
- Аммиак: в молекуле аммиака каждый атом азота имеет одну неподеленную электронную пару и три связи с атомами водорода.
- Метан: в молекуле метана каждый атом углерода имеет четыре одиночные связи с атомами водорода, образуя тетраэдральную структуру.
- Сернистый ангидрид: молекула сернистого ангидрида содержит два атома кислорода, каждый из которых имеет две двойные связи с атомами серы, а также две неподеленные пары электронов.








