Электронное строение атома является ключевым понятием в физике и химии. Оно описывает распределение электронов вокруг атомного ядра и определяет основные характеристики атома.
Атом состоит из положительно заряженного ядра и отрицательно заряженных электронов, которые обращаются вокруг ядра по определенным орбитам. Эти электроны обладают определенным количеством энергии и размещаются внутри атома в соответствии с определенными правилами.
Важно отметить, что электронное строение атома имеет огромное значение для объяснения химических свойств веществ. Оно определяет, как атомы взаимодействуют друг с другом и образуют химические связи. Кроме того, электронное строение атома также определяет, какие энергетические уровни электронов заполнены и какие элементы способны образовывать химические соединения.
Исследование электронного строения атома является основой для понимания многих явлений в химии и физике. Оно позволяет предсказывать свойства элементов и их соединений, а также разрабатывать новые материалы и технологии. Благодаря этому пониманию мы можем разгадывать секреты микромира и создавать уникальные вещества, которые применяются в различных областях науки и техники.
В итоге, электронное строение атома является основой для построения современной химической и физической теории и играет ключевую роль в наших представлениях о мире вокруг нас.
Что такое электронное строение атома?
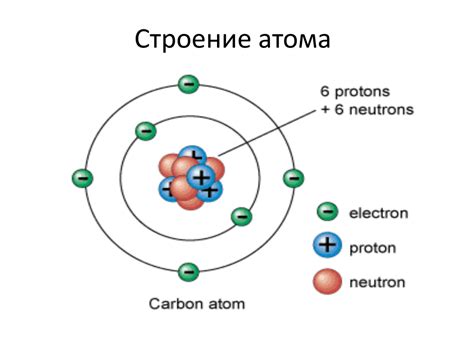
Атом состоит из положительно заряженного ядра и негативно заряженных электронов. Электроны располагаются на разных энергетических уровнях, называемых электронными оболочками. Каждая оболочка может содержать определенное количество электронов: первая оболочка – до 2 электронов, вторая – до 8 электронов и так далее.
Количество электронов в атоме определяется его атомным номером, который равен количеству протонов в ядре. Например, у атома кислорода атомный номер равен 8, и он имеет 8 электронов.
Чтобы понять, как распределены электроны в атоме, используют электронную конфигурацию, которая показывает, сколько электронов расположено на каждой электронной оболочке. Например, электронная конфигурация кислорода может быть обозначена как 1s² 2s² 2p⁴, что означает, что на первом энергетическом уровне находятся 2 электрона, на втором – 2 электрона, а на третьем – 4 электрона.
Электронное строение атома играет важную роль в химических реакциях, поскольку электроны определяют активность атома. Взаимодействия между атомами основаны на перемещении, приобретении или потере электронов. Изменение электронного строения атомов приводит к образованию новых веществ и реакциям, которые происходят в химических процессах.
Исследование электронного строения атомов помогает понять устройство вещества на молекулярном уровне, предсказывать химические свойства материалов и разрабатывать новые вещества с заданными свойствами.
Определение и суть концепции
Электронные оболочки представляют собой объемные области пространства, в которых можно найти электрон с определенной энергией. Эти оболочки разделены на подуровни - s, p, d, f, которые имеют определенный момент магнитного спина и определяют форму электронной орбитали.
Электроны наиболее стабильно находятся на первом энергетическом уровне, ближе всего к ядру. На каждом следующем уровне оболочек энергия электронов повышается, что проявляется в их удалении от ядра. Это означает, что чем дальше от ядра находится оболочка, тем выше энергия электронов, и они могут легче переходить с одного энергетического уровня на другой.
Значение электронного строения атома в химии
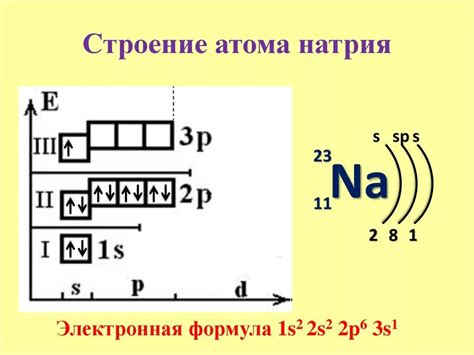
Знание электронного строения атома позволяет понять и объяснить различные явления и свойства веществ. Например, электронное строение определяет валентность атома, то есть его способность участвовать в химических реакциях и образовании химических связей.
Электронное строение также играет важную роль в атомной и молекулярной спектроскопии. Изменение распределения электронов при переходах между энергетическими уровнями вызывает излучение или поглощение электромагнитной радиации определенной частоты, что позволяет исследовать состав и структуру веществ.
Кроме того, электронное строение атома определяет его химическую активность и реакционную способность. Например, атомы, у которых валентная оболочка не заполнена полностью, имеют большую склонность к образованию химических связей и участию в химических реакциях. Это является основой для объяснения химических свойств и реакций различных веществ.
Таким образом, электронное строение атома является фундаментальным понятием в химии, позволяющим понять и объяснить различные химические явления и свойства веществ, а также предсказать исход химических реакций.
Ключевые компоненты электронного строения атома
Атом, как наименьшая частица химического элемента, имеет сложное электронное строение, которое определяет его физические и химические свойства. Электронное строение атома включает в себя несколько ключевых компонентов.
Электроны - негативно заряженные элементарные частицы, которые обращаются вокруг ядра атома. Они имеют очень малую массу и неизмеримо малый размер. Количество электронов в атоме определяется его атомным номером и равно количеству протонов в ядре.
Энергетические уровни - различные энергетические уровни, на которых могут находиться электроны в атоме. Они образуют энергетическую оболочку и обозначаются числами (n = 1, 2, 3 и т. д.). Чем больше энергетический уровень, тем дальше от ядра находятся электроны на этом уровне.
Электронные подуровни - подуровни на энергетических уровнях, на которых могут находиться электроны. Они обозначаются буквами (s, p, d, f) и определяют форму орбитали электронов. Например, уровень n = 2 имеет подуровни s и p.
Электронные орбитали - трехмерные пространственные области вокруг ядра, в которых вероятность обнаружить электрон наиболее высока. Они имеют форму шаров (s), шестилучевую форму (p), двухсотенную форму (d) и сложную форму (f).
Электронные пары - два электрона, занимающих одну орбиталь, которые имеют противоположные спины. Электронные пары могут быть общими, то есть принадлежать двум атомам в молекуле, или одиночными, когда оба электрона принадлежат только одному атому.
Понимание ключевых компонентов электронного строения атома позволяет учитывать взаимодействие атомов и понимать химические свойства веществ.
Электронные оболочки и их роль в строении атома
Атом состоит из ядра, которое содержит протоны и нейтроны, и электронных оболочек, на которых располагаются электроны. Электроны обращаются вокруг ядра на определенных энергетических уровнях, называемых оболочками или электронными орбиталями.
Каждая электронная оболочка имеет определенную энергию. Ближайшая к ядру оболочка имеет наиболее низкую энергию, и эта энергия увеличивается с удалением от ядра. Обычно атом имеет несколько электронных оболочек, в зависимости от количества электронов, которыми он обладает.
Электроны находятся в электронных оболочках благодаря силе притяжения между ними и протонами ядра. Они занимают определенные орбитали, которые могут быть заполнены определенным количеством электронов. По принципу набивания, каждая следующая электронная оболочка может содержать больше электронов, чем предыдущая.
Распределение электронов по оболочкам является важным для определения химических и физических свойств атома. Оно определяет возможность атома вступать в химические реакции, его валентность и способность образовывать химические связи с другими атомами. Также число электронов в каждой оболочке определяет энергетическую устойчивость атома.
Электронные оболочки также играют важную роль в формировании электронной конфигурации атома, которая описывает распределение электронов по оболочкам и суборбиталям. Электронная конфигурация является основой для понимания и предсказания различных свойств атомов и молекул.
Квантовые числа и электронные уровни
Электроны в атоме распределяются по различным энергетическим уровням, или орбиталям. Для описания этих уровней и распределения электронов используются квантовые числа.
- Основное квантовое число (n) определяет энергию и размер орбитали. Оно может принимать любое положительное целое значение (1, 2, 3 и так далее).
- Орбитальное квантовое число (l) определяет форму орбитали и связано с моментом импульса электрона. Оно может принимать значения от 0 до (n-1), где n - основное квантовое число.
- Магнитное квантовое число (m) определяет ориентацию орбитали в пространстве. Оно может принимать значения от -l до l.
- Спиновое квантовое число (s) определяет направление вращения электрона вокруг своей оси. Оно может быть равно +-1/2.
Комбинация этих квантовых чисел полностью описывает электронное строение атома и позволяет предсказывать распределение электронов по орбиталям, а также их взаимное взаимодействие.
Квантовые числа также определяют энергетические уровни электронов. Уровни с одинаковыми значениями основного квантового числа образуют энергетические оболочки. Например, уровни с основным квантовым числом n=1 образуют первую энергетическую оболочку, уровни с n=2 - вторую оболочку и так далее.
Понимание квантовых чисел и электронных уровней является фундаментальным для понимания и объяснения химических свойств и реакций, а также для разработки новых материалов и технологий.








