Электронная конфигурация атома - это упорядоченная расстановка электронов в его энергетических уровнях и подуровнях. Она описывает, как электроны распределены вокруг ядра атома и помогает понять его химические и физические свойства.
В основе электронной конфигурации лежит принцип заполнения энергетических уровней электронами в соответствии с правилами Клейна-Гордона и правилом Паули. Первое правило гласит, что электроны заполняют энергетические уровни по возрастанию энергии. Второе правило запрещает наличие двух электронов с одинаковыми квантовыми числами в одном энергетическом уровне или подуровне.
Знание электронной конфигурации позволяет понять, почему некоторые элементы обладают большей реакционной способностью или меньшей электронной аффинностью. Электронная конфигурация также помогает определить, какие электроны могут участвовать в химических реакциях и образовании химических связей.
«Электронная конфигурация - это своего рода "отпечаток" атома, который помогает нам разгадать его химические тайны и понять его поведение в химических реакциях».
Благодаря электронной конфигурации можно определить, к какой группе периодической системы относится элемент и какие свойства у него преобладают. Также, электронная конфигурация является важным инструментом в исследовании электронной структуры и свойств различных материалов, а также использование электронных конфигураций атомов является основой для объяснения явлений, происходящих в молекулах и кристаллах.
Электронная конфигурация атома: определение и значение
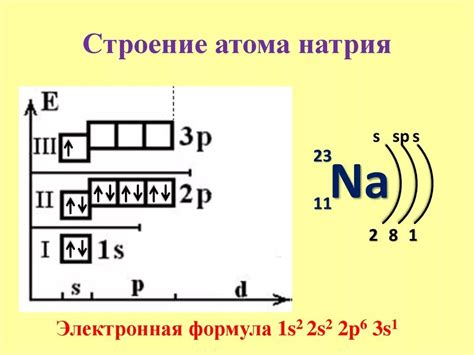
Знание электронной конфигурации атомов позволяет предсказывать и объяснять их химические свойства и взаимодействия. Она позволяет определить степень устойчивости атома, его восприимчивость к химическим реакциям и возможность образования химических связей.
Значение электронной конфигурации атома расширяется и на макроскопический уровень. Она позволяет определить схему строения электронных оболочек атомов в молекулях и кристаллах, что имеет прямое влияние на их физические и химические свойства.
Для определения электронной конфигурации атома используются различные правила и модели, такие как правило главного квантового числа и правило заполнения подуровней. При анализе электронной конфигурации атома использование электронных обозначений, таких как s, p, d и f, помогает легко визуализировать распределение электронов.
Электронная конфигурация атома играет ключевую роль в химии и физике, позволяя понять и объяснить характеристики и поведение атомов и веществ в мире вокруг нас.
История открытия электронов и развитие концепции
В конце 19 века учёные обнаружили, что вещества проявляют определённые химические свойства, которые не могут быть объяснены только наличием протонов и нейтронов в ядре атома. В 1897 году Джозеф Джон Томпсон открыл электрон, негативно заряженную частицу, которую он назвал "корпускулой". Томпсон предположил, что электроны находятся в атоме в виде отдельных частиц, "плавающих" в положительно заряженном ядре.
Однако в начале 20 века выполнение различных экспериментов показало, что модель Томпсона не может полностью объяснить наблюдаемые свойства атомов. Используя эксперимент Джона Резерфорда, Нильс Бор в 1913 году предложил квантовую модель атома, в которой электроны находятся на определённых энергетических уровнях, называемых орбиталями.
В дальнейшем концепция электронной конфигурации атома была развита и уточнена учёными, в результате чего было установлено, что электроны на орбиталях располагаются в подуровнях, образующих шкалу энергии:
- s-подуровень, имеющий наименьшую энергию;
- p-подуровень;
- d-подуровень;
- f-подуровень, имеющий наибольшую энергию.
Электронная конфигурация является важным инструментом для понимания свойств атомов и их химического поведения. Она позволяет предсказывать, какие соединения могут образовываться между атомами и почему одни элементы проявляют определённые свойства, а другие - совершенно различные.
Как определяется электронная конфигурация атома?
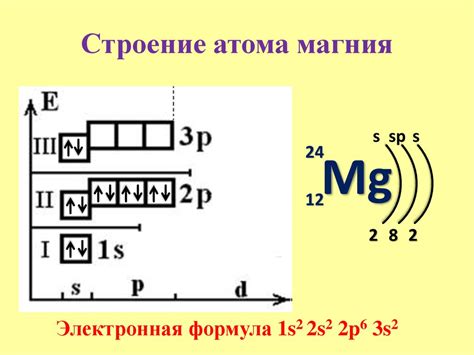
Электронная конфигурация атома представляет собой предельное расположение электронов во всех энергетических уровнях атома. Она определяет, какие энергетические уровни заняты электронами и сколько электронов находится на каждом уровне.
Определение электронной конфигурации атома основывается на принципах дискретных энергетических уровней и принципе Паули.
Принцип дискретных энергетических уровней утверждает, что атом имеет определенные энергетические уровни, на которых электроны могут находиться. Энергетические уровни обозначаются буквами s, p, d и f, и каждый уровень имеет определенную емкость для электронов.
Принцип Паули гласит, что в каждом энергетическом уровне может находиться не более двух электронов, причем они должны иметь противоположные спины.
Определение электронной конфигурации атома происходит путем заполнения энергетических уровней атома электронами в порядке возрастания их энергий. Электроны заполняют энергетические уровни сначала по одному, а затем парами с противоположными спинами, исходя из принципа Паули.
Таким образом, электронная конфигурация атома позволяет определить распределение электронов по энергетическим уровням, что важно для понимания химических свойств атома и его взаимодействий с другими атомами.
Значение электронной конфигурации в химии
Электронная конфигурация атома является важным понятием в химии и имеет несколько важных значений:
1. Определение свойств атома. Электронная конфигурация атома определяет его химические свойства и поведение. Она влияет на то, какие элементы могут образовывать соединения с данным атомом, его реакционную способность и степень валентности. |
2. Понимание различных орбиталей и подуровней. Электронная конфигурация помогает понять, какие орбитали и подуровни имеют электроны и как они заполняются. Это важно для понимания структуры атома и его энергетических уровней. |
3. Объяснение периодической системы элементов. Электронная конфигурация играет ключевую роль в организации элементов в периодической системе. Она позволяет объяснить изменение химических свойств элементов вдоль периодов и групп. |
4. Способ представления атома и его электронной структуры. Электронная конфигурация используется для визуального представления атомов и их электронной структуры. Она позволяет увидеть, как электроны распределены по энергетическим уровням и орбиталям. |








