Химический состав вещества определяется атомным составом элементов, из которых оно состоит. Зарядовое число - это важное понятие, которое помогает определить, какие ионы образуются при химических реакциях и каким образом происходит взаимодействие элементов.
Зарядовое число является индикатором электронного состояния атомов. Он определяет количество электронов, которые атом может принять или отдать при взаимодействии с другими элементами. Положительные зарядовые числа указывают на то, что атом отдал электроны, а отрицательные - что атом принял дополнительные электроны.
Зарядовое число оказывает важное влияние на химические свойства элементов. Оно определяет ионизационную способность элемента и его способность образовывать соединения с другими веществами. Например, элементы с положительными зарядовыми числами склонны образовывать катионы, а элементы с отрицательными зарядовыми числами - анионы.
Зарядовое число также важно для определения молекулярной и ионной структуры соединений. Правильное понимание зарядовых чисел помогает химикам предсказывать результаты реакций и разрабатывать новые вещества с желаемыми свойствами.
Изучение зарядовых чисел и их влияния на химический состав элементов позволяет углубить наши знания о строении вещества и реакции его компонентов. Это основа для многих отраслей химии, таких как органическая химия, неорганическая химия и физическая химия.
Зарядовое число и его значение

Зарядовое число может быть положительным или отрицательным и представляет собой число, которое показывает, сколько электронов превышает или недостает внешнему электронному облаку атома или иона.
Положительное зарядовое число указывает на дефицит электронов во внешней оболочке атома или на дополнительное количество протонов в ядре. Например, у иона натрия (Na+) зарядовое число равно +1, что означает, что в атоме натрия на один электрон меньше, чем протонов.
Отрицательное зарядовое число указывает на превышение числа электронов над числом протонов. Например, у иона хлора (Cl-) зарядовое число равно -1, что означает, что в атому хлора на один электрон больше, чем протонов.
Зарядовое число играет важную роль при определении химического состава элементов и при составлении химических формул и реакций. Оно позволяет определить, сколько ионов каждого типа принимает участие в реакциях и какие соединения образуются при взаимодействии различных веществ.
Что такое зарядовое число в химии
Положительное зарядовое число означает, что атом отдал один или несколько электронов, при этом количество протонов в ядре атома остается неизменным. Этот тип зарядового числа часто встречается у ионов металлов, так как они имеют тенденцию отдавать свои внешние электроны для образования положительно заряженных ионов.
Отрицательное зарядовое число указывает, что атом принял один или несколько электронов от другого атома. В таком случае, количество электронов становится больше количества протонов в ядре, что приводит к образованию отрицательно заряженных ионов. Атомы неметаллов чаще всего образуют отрицательные ионы, так как они имеют большую электроотрицательность и стремятся принять электроны, чтобы заполнить свою внешнюю оболочку.
Зарядовое число также играет важную роль при определении химической формулы соединений. Оно указывает на количество ионов каждого вида, необходимых для достижения электронной стабильности. Благодаря зарядовым числам мы можем понять, какие элементы образуют ионы, и какое количество электронов переходит при образовании соединений.
Как определяется зарядовое число
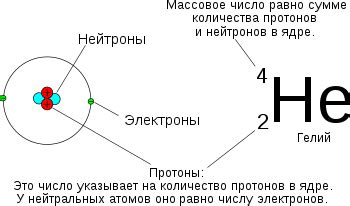
Зарядовое число атома определяется его расположением в периодической таблице химических элементов. В верхней части элементов в таблице находятся элементы с отрицательным зарядом, или анионы, такие как кислород (–2) или хлор (–1). В нижней части таблицы находятся элементы с положительным зарядом, или катионы, такие как натрий (+1) или железо (+3).
Зарядовое число иона зависит от его химической формулы. Например, ион натрия имеет зарядовое число +1, а ион хлора имеет зарядовое число –1. Когда ионы соединяются, их зарядовые числа складываются, чтобы получить общую нейтральную зарядность соединения.
Обычно зарядовое число указывается вверху справа от символа элемента или иона. Если зарядовое число не указано, предполагается, что оно равно 0. Зарядовое число играет важную роль в определении химического состава и свойств различных соединений и является основой для понимания реакций между химическими элементами.
Значение зарядового числа в определении химического состава
Зарядовое число играет важную роль при определении химического состава элементов. Зарядовое число показывает, сколько электронов элемент отдал или принял в реакции.
Как известно, атом состоит из протонов, нейтронов и электронов. Протоны имеют положительный заряд, нейтроны не имеют заряда, а электроны имеют отрицательный заряд. Зарядовое число равно разнице между количеством протонов и количеством электронов.
Положительное зарядовое число указывает на то, что элемент отдал электроны в реакции и стал ионом с положительным зарядом. Например, ион натрия имеет зарядовое число +1, что означает, что натрий отдал один электрон.
Отрицательное зарядовое число указывает на то, что элемент принял электроны в реакции и стал ионом с отрицательным зарядом. Например, ион хлора имеет зарядовое число -1, что означает, что хлор принял один электрон.
Зарядовое число помогает определить состав ионной решетки вещества и его химические свойства. Зная зарядовые числа элементов, можно установить, сколько электронов элемент отдал или принял в реакции, а значит, определить его химическое состав.
Как зарядовое число определяет свойства элементов
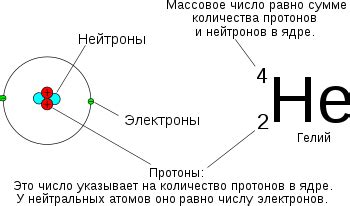
Зарядовое число определяет, как элемент взаимодействует с другими элементами и молекулами. В химических реакциях, элементы стремятся достичь стабильной электронной конфигурации, что позволяет им иметь наиболее низкую энергию.
Если элемент имеет положительное зарядовое число, это означает, что он потерял одно или несколько электронов и стал ионом с положительным зарядом. Такие элементы, как натрий (Na) и калий (K), способны легко отдавать свои электроны, и они обладают реактивностью и металлическими свойствами.
С другой стороны, если элемент имеет отрицательное зарядовое число, это означает, что он приобрел одно или несколько электронов и стал ионом с отрицательным зарядом. Такие элементы, как кислород (O) и хлор (Cl), имеют высокую электроотрицательность и способность притягивать электроны. Они обладают реактивностью и non-металлическими свойствами.
Зарядовое число также определяет, как элементы образуют химические связи друг с другом. Элементы с положительным зарядом могут притягивать элементы с отрицательным зарядом для формирования ионных связей. Например, натрий образует ионную связь с хлором, образуя хлорид натрия (NaCl).
Важно отметить, что зарядовое число также может изменяться для элементов в разных химических соединениях. Например, кислород может иметь заряд -2 в большинстве соединений, но может иметь заряд -1 в кислородиде водорода (HO). Это объясняется тем, что зарядовое число зависит от того, как элемент взаимодействует с другими элементами и какие электроны он может потерять или приобрести.
Таким образом, зарядовое число играет важную роль в определении свойств элементов и их химического состава. Оно помогает понять, как элементы образуют химические связи, реагируют с другими элементами и влияют на их физические и химические свойства.
Связь между зарядовыми числами и возможными соединениями
Зарядовое число, также известное как валентность, определяет химический состав элементов и их способность образовывать соединения. Валентность указывает на количество электронов, которое элемент может отдать или принять при взаимодействии с другими элементами.
Валентность элемента влияет на тип и химические свойства соединений, которые он может образовывать. Элементы с положительной валентностью имеют свойство отдавать электроны и образовывать ионы с положительным зарядом. Например, натрий имеет валентность +1 и может образовывать соединения с различными отрицательными ионами, такими как хлоридный и сульфатный ионы.
Элементы с отрицательной валентностью имеют свойство принимать электроны и образовывать ионы с отрицательным зарядом. Например, кислород имеет валентность -2 и может образовывать соединения с положительными ионами, такими как ионы металлов. Кислород также может образовывать двойные и тройные связи с другими элементами, такими как углерод в органических соединениях.
Зарядовое число также играет важную роль в определении стехиометрии соединений. Стехиометрия отражает взаимное соотношение атомов разных элементов в соединении. Например, вода (H2O) состоит из двух атомов водорода и одного атома кислорода. Вода образуется путем обмена электронами между атомами водорода и кислорода, чтобы удовлетворить их валентности.
Изучение зарядовых чисел и их связи с возможными соединениями позволяет понять, как образуются и как взаимодействуют различные химические элементы. Это знание является основой для понимания многих химических реакций и процессов, а также может быть использовано для проектирования новых соединений и материалов.
Примеры применения зарядовых чисел

Зарядовые числа играют ключевую роль в химии, определяя химический состав и свойства элементов. Ниже приведены несколько примеров их применения:
1. Определение стехиометрии реакций: Зарядовые числа позволяют определить соотношение между элементами в химической реакции. Они помогают расчету количества веществ, участвующих в реакции, и прогнозированию продуктов реакции.
2. Классификация химических соединений: Зарядовые числа позволяют классифицировать химические соединения на ионы, катионы и анионы. Например, катионы имеют положительное зарядовое число, а анионы имеют отрицательное зарядовое число.
3. Построение электронной конфигурации: Зарядовые числа помогают представить электронную конфигурацию атома или иона. Они указывают на количество потерянных или полученных электронов и помогают определить расположение электронов в энергетических уровнях.
4. Определение оксидации и восстановления: Зарядовые числа позволяют определить, происходит ли окисление или восстановление в реакции. Окисление отражается увеличением зарядового числа, а восстановление - его уменьшением.
5. Идентификация химических элементов: Зарядовые числа помогают идентифицировать химические элементы в соединениях. Например, зарядовое число Na+ указывает на катион натрия, а зарядовое число Cl- указывает на анион хлора.
Роль зарядовых чисел в органической химии
В органической химии зарядовые числа играют важную роль при определении химического состава и свойств органических соединений. Зарядовое число представляет собой электрический заряд, который несет атом или ион. Оно определяется отношением количества протонов и электронов в атоме или ионе.
Зарядовые числа в органической химии могут быть положительными, отрицательными или нейтральными. Они позволяют определить, какие атомы принимают участие в химической реакции и какие ионы образуются при образовании органических соединений.
В органической химии зарядовые числа применяются для обозначения функциональных групп. Функциональные группы - это атомы или группы атомов, которые вместе образуют основной центр активности молекулы и определяют ее свойства и реакционную способность.
Например, в органических кислотах зарядовое число на кислороде функциональной группы карбоксильной группы равно -1, что указывает на то, что данный кислород несет отрицательный заряд. В этом случае, карбоксильная группа является донором протона и обладает кислотными свойствами.
Зарядовое число также позволяет определить степень окисления атомов в молекуле. Окисление - это процесс передачи электронов от одного атома другому. Зарядовое число указывает на то, сколько электронов атом или ион принял или отдал в химической реакции.
В заключение, зарядовые числа являются важными инструментами в органической химии, позволяющими определить химический состав и свойства органических соединений, а также реакционную способность иоксидационный статус атомов и ионов.








