Атом является основной единицей химического элемента. Каждый элемент обладает своим уникальным атомным составом, который определяет его свойства и химическую активность. Чтобы лучше понять строение атома, необходимо ознакомиться с его основными компонентами.
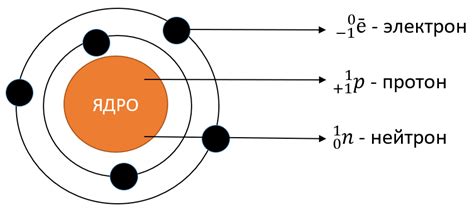
Основными компонентами атома являются электроны, протоны и нейтроны. Электроны являются негативно заряженными элементарными частицами, которые обращаются по орбитам вокруг ядра атома. Протоны - положительно заряженные частицы, которые находятся в ядре атома. Нейтроны - частицы, не имеющие заряд. Они также находятся в ядре атома и отвечают за его стабильность.
Ядро атома состоит из протонов и нейтронов, они называются нуклонами. Число протонов в атоме определяет его атомный номер и характеристики элемента. Количество электронов в атоме равно числу протонов, что обеспечивает электрическую нейтральность атома. Таким образом, атом состоит преимущественно из области, где находятся электроны, и небольшого и крайне плотного ядра, где сосредоточены протоны и нейтроны.
Понимание строения атома позволяет лучше понять его химические и физические свойства, а также рационально использовать элементы в химической промышленности и других областях науки и техники. Изучение атомного строения помогает углубить наши знания о многообразии веществ и их взаимодействии, что открывает новые перспективы в современной науке.
Атом химического элемента: строение и компоненты
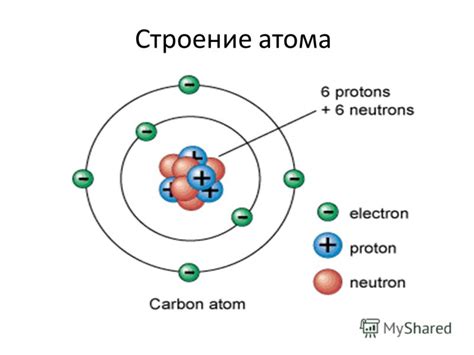
Ядро атома находится в его центре и содержит протоны и нейтроны. Протоны - это частицы с положительным зарядом, а нейтроны - частицы без заряда. Протоны и нейтроны объединены вместе и составляют существенную часть массы атома. Количество протонов в ядре определяет химические свойства элемента и называется атомным номером.
Вокруг ядра атома располагается электронная оболочка. Оболочка состоит из энергетических уровней, на которых движутся электроны. Электроны являются негативно заряженными частицами и сохраняют электрический баланс атома. Количество электронов также определяет химические свойства элемента.
Распределение электронов по энергетическим уровням происходит в соответствии с моделью Бора-Резерфорда. Модель предполагает, что электроны занимают наиболее низкий доступный уровень энергии, а каждый уровень может вместить определенное количество электронов.
Знание строения атома химического элемента позволяет понять его свойства и влияние на химические реакции. Конфигурация электронов определяет химическую активность элемента и его способность взаимодействовать с другими атомами.
В итоге, понимание основных компонентов атома является важным для понимания химии и ее применения в различных сферах жизни, включая медицину, энергетику и материаловедение.
Нуклеонный центр атома
Электронная оболочка и орбитали

Орбитали разделяются на несколько типов, называемых s, p, d, f орбиталями. Орбитали типа s имеют форму сферы и наиболее близки к ядру атома. Они рассматриваются как наиболее низкоэнергетические. Орбитали типа p имеют форму двуполюсника и находятся на некотором расстоянии от ядра. Орбитали типа d имеют более сложную форму и расположены дальше от ядра, чем орбитали типа p. Орбитали типа f имеют еще более сложную форму и находятся очень далеко от ядра.
Электроны располагаются в орбиталях в соответствии с правилом Клейна. Согласно этому правилу, орбитали заполняются поочередно, начиная с орбиталей с наименьшей энергией. При заполнении орбиталей каждая орбиталь должна быть заполнена одним электроном перед тем, как второй электрон может быть размещен в этой же орбитали.
Протоны: положительно заряженные частицы
Масса протона составляет около 1,67 × 10-27 килограмма, что примерно в 1836 раз больше массы электрона. За счет своей массы и заряда протоны являются ключевыми факторами в определении свойств и химической активности атомов.
| Свойство | Значение |
|---|---|
| Масса | 1,67 x 10-27 кг |
| Заряд | +1 |
| Местонахождение | Ядро атома |
Протоны играют важную роль в химических реакциях и взаимодействии атомов между собой. Взаимодействие между протонами и электронами определяет свойства различных элементов и их способность образовывать химические связи.
Исследование строения и свойств протонов играет ключевую роль в области ядерной физики и атомной энергетики, а также в разработке новых материалов и прогрессивных технологий.
Нейтроны: нейтральные частицы в ядре
Масса нейтрона составляет около 1,675 × 10^-27 килограмма. Это позволяет нейтронам вносить существенный вклад в общую массу атомного ядра. Отношение числа протонов к числу нейтронов в ядре определяет изотопический состав элемента. Существует несколько изотопов каждого химического элемента с разными сочетаниями протонов и нейтронов.
Нейтроны также играют ключевую роль в процессах расщепления ядра, таких как ядерный распад и ядерные реакции. Они могут быть выброшены из ядра при делении тяжелых элементов или поглощены при слиянии легких элементов. Открытие нейтронов дало возможность улучшить понимание ядерных процессов и использовать их в различных областях, таких как ядерная энергетика и медицина.
Электроны: негативно заряженные частицы
Масса электрона равна примерно 9,1x10^-31 килограмма, что является очень маленьким значением по сравнению с массой протона и нейтрона. Это значит, что электрон несет незначительную массу, но играет важную роль в химических реакциях и связях между атомами.
Электроны выстроены на разных энергетических уровнях вокруг ядра атома, которые называются электронными оболочками. Первая оболочка может содержать максимум 2 электрона, вторая - 8, третья - также 8 электронов и так далее.
Количество электронов во внешней электронной оболочке влияет на химические свойства атома. Атомы стремятся заполнить свои внешние оболочки электронами, чтобы достигнуть устойчивого состояния. Именно электроны во внешней оболочке определяют, могут ли атомы образовывать химические связи и какие ионы они могут образовывать.
Перемещение электронов между атомами или передача электронов от одного атома к другому играет решающую роль в химических реакциях. При этом электроны - это негативно заряженные частицы, поэтому перемещение электронов создает электрическую силу притяжения или отталкивания между атомами.
Энергетические уровни электронной оболочки
Электронная оболочка атома химического элемента состоит из энергетических уровней, на которых находятся электроны. Эти уровни представляют собой различные энергетические состояния, которые электрон может занимать в атоме.
Всего существуют несколько энергетических уровней, которые обозначаются буквами латинского алфавита: K, L, M, N и т.д. Уровень K наименее удалён от ядра атома и имеет наименьшую энергию, а последующие уровни имеют более высокую энергию.
Каждый энергетический уровень может вмещать определенное количество электронов. На уровне K может находиться до 2 электронов, на уровне L – до 8 электронов, на уровне M – до 18 электронов и так далее.
Электроны находятся на энергетических уровнях благодаря взаимодействию с ядром атома и другими электронами. Каждый электрон старается занять наиболее низкий доступный энергетический уровень, чтобы обеспечить более устойчивое состояние атома.
Понимание энергетических уровней электронной оболочки позволяет объяснить химические свойства и реактивность атомов различных химических элементов, а также описать их электронную конфигурацию и расположение на периодической системе.








