Содержание по массе – это величина, используемая для определения доли определенного вещества в смеси или материале. Оно указывает на то, какой процент массы смеси или материала составляет искомое вещество. Содержание по массе является одной из основных характеристик, используемых в химии, аналитике и других науках.
Основное понятие, связанное с содержанием по массе, - это процентное содержание. Процентное содержание по массе обычно обозначается знаком % и выражается числом. Например, если говорят, что в смеси содержится 20% по массе соли, это означает, что на каждые 100 граммов смеси приходится 20 граммов соли. Другими словами, доля соли в этой смеси составляет 20%.
Примером использования содержания по массе может быть расчет концентрации вещества в растворе. Например, если нам известно, что масса соли в растворе составляет 10 г, а общая масса раствора равна 100 г, мы можем вычислить содержание соли по массе следующим образом: (10 г / 100 г) * 100% = 10%. Таким образом, содержание по массе соли в этом растворе равно 10%.
Важно помнить, что содержание по массе всегда относится к общей массе смеси или материала, а не к объему.
Содержание по массе имеет большое значение в различных областях, включая химическую промышленность, фармацевтику, пищевую промышленность и др. Оно позволяет более точно определять состав веществ в смесях и материалах, а также контролировать качество и соответствие заданным требованиям. Понимание основных понятий и примеров использования содержания по массе является важным шагом в освоении химии и аналитической химии.
Масса вещества и ее измерение
Единицами измерения массы в международной системе единиц (СИ) является килограмм (кг). Однако, для измерения массы малых объектов часто используют граммы (г), которые являются тысячной долей килограмма.
Измерение массы может производиться с помощью различных приборов, таких как весы или балансы. Весы позволяют сравнить массу объекта с определенной известной массой, а балансы позволяют определить массу путем уравновешивания объекта с известной массой на разных лучах весов.
Примеры объектов, содержащихся в указанной массе, могут включать такие вещи, как:
- Яблоко массой 150 г
- Книга массой 500 г
- Чашка сахара массой 250 г
Знание массы вещества важно для различных областей науки и техники, таких как физика, химия, строительство и промышленность. Именно измерение массы позволяет устанавливать соотношения между различными веществами и осуществлять нужные расчеты.
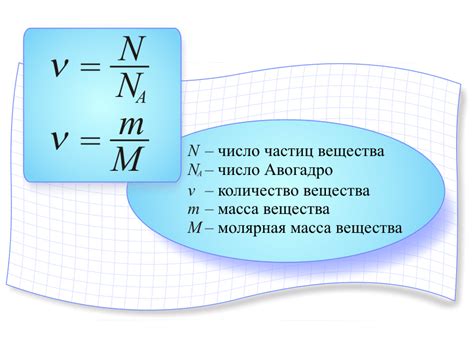
Молярная масса и Avogadro's number
Численность Авогадро, также известная как Avogadro's number, обозначается как 6.022 × 10^23 и представляет собой число молекул в одном моле вещества.
Молярная масса и численность Авогадро связаны формулой m = M/N, где m - масса одной молекулы вещества, M - молярная масса, а N - численность Авогадро.
Например, для молекулы воды (H2O) молярная масса равна приблизительно 18 г/моль. Это означает, что одна молекула воды имеет массу около 18 атомических единиц массы. В одном моле воды будет находиться 6.022 × 10^23 молекул, так как численность Авогадро равна этому значению.
Молярная концентрация в растворах
Для расчета молярной концентрации необходимо знать количество растворенного вещества (в молях) и объем растворителя (в литрах). Формула для расчета молярной концентрации выглядит следующим образом:
M = n/V
где M - молярная концентрация, n - количество растворенного вещества (в молях), V - объем растворителя (в литрах).
Например, если в 1 литре раствора содержится 0,5 моль соли, то молярная концентрация этого раствора будет равна 0,5 М.
Молярная концентрация является важным параметром в химии и используется для описания свойств растворов и проведения различных химических реакций.
| Молярная концентрация | Объем растворителя (л) | Количество растворенного вещества (моль) |
|---|---|---|
| 0,1 М | 1 л | 0,1 моль |
| 0,5 М | 2 л | 1 моль |
| 1 М | 1 л | 1 моль |
Процентное содержание по массе
Процентное содержание по массе рассчитывается путем определения массы вещества в отношении к общей массе системы. Это позволяет выразить количество вещества в процентах от общей массы смеси или реакционной среды.
Для расчета процентного содержания по массе необходимо знать массу исследуемого вещества и общую массу системы, в которой оно содержится. Формула для расчета процентного содержания по массе выглядит следующим образом:
Процентное содержание по массе (%) = (масса исследуемого вещества / общая масса системы) * 100%
Например, если взять смесь вещества A (масса 20 г) и вещества B (масса 80 г), так что общая масса системы составляет 100 г, то процентное содержание по массе вещества A будет:
Процентное содержание вещества A (%) = (20 г / 100 г) * 100% = 20%
Процентное содержание по массе широко применяется в химии и аналитической химии для характеристики состава смесей и растворов. Оно позволяет определить концентрацию вещества в пересчете на общую массу системы.
Массовое отношение и массовая доля

Чтобы понять, что такое массовое отношение и массовая доля, необходимо иметь представление о химическом соединении и его составных частях.
Массовое отношение - это численное соотношение массы одного элемента к массе другого элемента или соединения. Оно показывает, в каком количестве вещества одного вида соотносится с веществом другого в химическом соединении.
Массовое отношение обычно выражается в виде десятичной дроби или процента и позволяет определить, какие элементы присутствуют в соединении и в каких пропорциях.
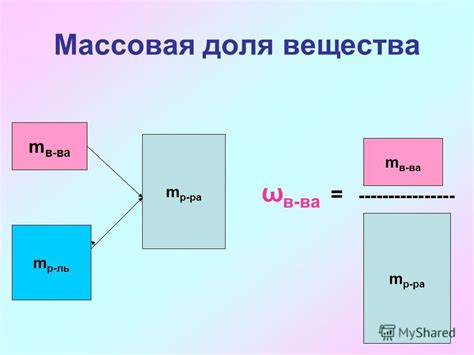
Массовая доля - это отношение массы определенного компонента к общей массе химического соединения. Она показывает долю, которую занимает данный компонент в общей массе соединения.
Массовая доля также может быть выражена в виде десятичной дроби или процента и используется для определения процентного содержания элементов или соединений в смесях и растворах.
Например, воде (H2O) массовая доля водорода составляет около 11%, а массовая доля кислорода - около 89%. То есть вода состоит из 11 грамм водорода и 89 грамм кислорода на 100 грамм вещества.
Массовое отношение и массовая доля являются важными понятиями в химии и помогают определить состав и свойства вещества. Понимание этих понятий позволяет более глубоко изучить химические реакции и взаимодействия различных веществ.
Примеры расчета массовой доли
Массовая доля представляет собой отношение массы определенного компонента к общей массе смеси. Рассмотрим несколько примеров расчета массовой доли.
Пример 1:
Допустим, у нас есть смесь, состоящая из 80 г соли и 120 г воды. Чтобы найти массовую долю соли, нужно разделить массу соли на общую массу смеси и умножить на 100%.
| Компонент | Масса (г) |
|---|---|
| Соль | 80 |
| Вода | 120 |
| Общая масса | 200 |
Массовая доля соли = (масса соли / общая масса) * 100%
Массовая доля соли = (80 г / 200 г) * 100%
Массовая доля соли = 40%
Пример 2:
Рассмотрим раствор, в котором содержится 30 г соли и 70 г воды. Чтобы найти массовую долю соли в этом растворе, нужно разделить массу соли на общую массу раствора и умножить на 100%.
| Компонент | Масса (г) |
|---|---|
| Соль | 30 |
| Вода | 70 |
| Общая масса | 100 |
Массовая доля соли = (масса соли / общая масса) * 100%
Массовая доля соли = (30 г / 100 г) * 100%
Массовая доля соли = 30%
Эти примеры демонстрируют, как можно рассчитать массовую долю определенного компонента в смеси. Зная массовую долю различных компонентов смеси, можно провести анализ и принять соответствующие решения.
Примеры расчета массового отношения
| Пример | Уравнение реакции | Массовое отношение |
|---|---|---|
| Сгорание метана | CH4 + 2O2 → CO2 + 2H2O | 1 : 2 : 1 : 2 |
| Образование воды | 2H2 + O2 → 2H2O | 2 : 1 : 2 |
| Процесс ферментации | C6H12O6 → 2C2H5OH + 2CO2 | 1 : 2 : 2 |
Как видно из таблицы, массовое отношение показывает, в каком соотношении участвуют вещества в реакции. Например, при сгорании метана одна молекула метана реагирует с двуми молекулами кислорода, образует одну молекулу углекислого газа и две молекулы воды.
Молярная доля и ее применение
Молярная доля выражается в виде десятичной дроби или в процентах и рассчитывается по формуле:
Молярная доля (X) = количество вещества компонента / сумма количеств вещества всех компонентов
Применение молярной доли позволяет определить процентное содержание компонентов в растворе или смеси, а также провести расчеты, связанные с реакциями веществ. Она широко используется в аналитической, органической и физической химии для описания состава различных систем.
Примеры использования молярной доли:
- Определение состава газовой смеси в атмосфере путем измерения молярной доли кислорода, азота, углекислого газа и других компонентов.
- Расчет концентрации раствора путем определения молярной доли растворенного вещества.
- Изучение реакций веществ на основе их молярной доли, что позволяет определить их сродство и скорость химических превращений.
Однако следует помнить, что молярная доля является безразмерной величиной и не зависит от единиц измерения.
В заключение, молярная доля является важным понятием в химии, которое позволяет описывать количественный состав различных смесей и проводить расчеты, связанные с химическими реакциями и концентрацией веществ.
Удельная массовая доля
Для вычисления удельной массовой доли необходимо знать массу компонента и массу всей смеси. Формула для расчета удельной массовой доли выглядит следующим образом:
- Удельная массовая доля = (масса компонента / масса смеси) * 100%
Например, у нас есть смесь, состоящая из 200 граммов железа и 800 граммов алюминия. Чтобы найти удельную массовую долю железа в этой смеси, нужно разделить массу железа на массу всей смеси и умножить на 100%:
- Удельная массовая доля железа = (200 г / (200 г + 800 г)) * 100% = 20%
Таким образом, удельная массовая доля железа в этой смеси составляет 20%.
Массовая доля и массовое отношение в химических реакциях
Массовая доля выражает отношение массы определенного элемента или соединения к общей массе смеси. Она обозначается символом "ω" и вычисляется по следующей формуле:
ω = (масса элемента / масса смеси) × 100%
Массовое отношение, также называемое также как массовая пропорция или массовое соотношение, определяет количество вещества, участвующего в химической реакции, относительно других компонентов. Оно выражается в форме коэффициентов, которые показывают, в каких пропорциях вещества реагируют и образуют новые соединения.
Для наглядного представления массового отношения можно использовать таблицу, где указывается масса каждого компонента вещества. Например, для реакции сгорания метана (CH4) в кислороде (O2) и образования углекислого газа (CO2) и воды (H2O), массовое отношение будет следующим:
| Вещество | Масса, г |
|---|---|
| Метан (CH4) | 16 г |
| Кислород (O2) | 64 г |
| Углекислый газ (CO2) | 44 г |
| Вода (H2O) | 36 г |
Из данной таблицы видно, что для образования 44 г углекислого газа и 36 г воды нужно 16 г метана и 64 г кислорода. Таким образом, массовое отношение между метаном и кислородом будет 1:4, а массовое отношение между метаном и образовавшимися веществами (углекислым газом и водой) будет 1:5.
Массовая доля и массовое отношение являются важными понятиями, которые позволяют химикам проводить точные расчеты и предсказывать результаты химических реакций. Они позволяют определить, сколько вещества необходимо использовать или образуется в результате химической реакции.








