Реакция синтеза – один из фундаментальных процессов химических превращений, заключающийся в соединении двух или более веществ для образования нового вещества. Это один из основных способов синтеза органических и неорганических соединений.
Основной принцип реакции синтеза состоит в том, что реагенты, участвующие в реакции, обладают свободными электронными парами или несвязанными электронами, которые могут соединяться с другими атомами или ионами. При этом образуются связи между атомами или ионами, что приводит к образованию новых соединений.
Реакция синтеза широко используется во многих отраслях химии, включая органическую химию, неорганическую химию и аналитическую химию. В органической химии реакция синтеза часто применяется для получения сложных органических соединений, таких как лекарственные препараты и полимеры. В неорганической химии реакция синтеза используется для получения неорганических соединений и материалов, таких как кристаллы и сплавы. В аналитической химии реакция синтеза может использоваться для определения концентрации вещества в образце.
Реакция синтеза: что это такое?

Основной принцип реакции синтеза заключается в том, что две или более реагирующие вещества образуют одно или более новых веществ, имеющих новые свойства и состав.
Реакция синтеза происходит путем образования химических связей между атомами или ионами исходных веществ. В результате этого процесса образуется новое вещество – продукт реакции.
Примерами реакций синтеза могут служить: соединение металлов с кислородом при образовании оксидов, соединение неорганических кислот с основаниями при образовании солей, образование органических соединений и др.
Реакции синтеза имеют большое значение в различных областях химии, таких как органическая химия, неорганическая химия, фармацевтика и т.д. Они используются для получения новых веществ с нужными свойствами и улучшения существующих продуктов.
Функция и значение реакции синтеза
Основная функция реакции синтеза заключается в создании новых веществ и образовании сложных химических соединений. Этот тип реакции играет важную роль в многих химических процессах, таких как создание новых материалов, синтез органических соединений, образование минералов в геологических процессах и многое другое.
Значение реакции синтеза расширяет наши знания о химических веществах и их свойствах. Через изучение реакций синтеза мы можем получить новые материалы с нужными химическими свойствами и усовершенствовать существующие процессы и технологии.
Реакция синтеза является основой многих химических и физических наук, таких как органическая химия, неорганическая химия, фармацевтика, материаловедение и другие. Исследование реакций синтеза помогает расширить наши знания о строении и свойствах веществ, а также приведет к открытию новых принципов и методов синтеза веществ, которые будут полезны в разных отраслях науки и технологии.
В заключение, реакция синтеза играет важную роль в нашей жизни и является важным инструментом в различных областях науки и технологии. Понимание функции и значения реакции синтеза позволяет нам лучше понять и контролировать химические процессы, что имеет огромное значение для развития науки и промышленности.
Основные понятия реакции синтеза
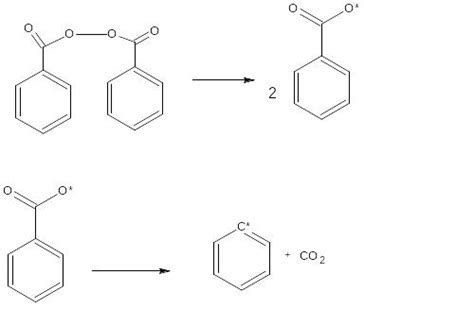
Вещества, участвующие в реакции синтеза, называются реагентами, а полученное в результате новое вещество называется продуктом.
Реакции синтеза могут происходить между различными типами веществ, включая элементы, соединения и ионы. Одним из примеров реакции синтеза является соединение кислорода и водорода для образования воды:
2H2 + O2 → 2H2O
Эта реакция моделирует процесс, который происходит в результате горения водорода в кислороде.
Реакции синтеза играют важную роль во многих областях науки и промышленности. Они используются для синтеза различных соединений, например лекарственных препаратов, пластмасс, косметических продуктов и многих других веществ.
Основные понятия реакции синтеза включают вещества-реагенты, продукты, стехиометрические коэффициенты, которые показывают, в каком соотношении реагенты преобразуются в продукты, и условия, которые могут влиять на скорость и направление реакции.
Реакции синтеза могут быть эндотермическими или экзотермическими. В эндотермической реакции поглощается тепловая энергия, в то время как в экзотермической реакции выделяется тепловая энергия.
Важно знать основные понятия реакции синтеза для понимания и анализа химических процессов, а также для разработки новых соединений и материалов.
Эдукты и продукты реакции
Эдукты – это вещества, участвующие в химической реакции и претерпевающие изменения. Они являются исходными компонентами реакции и влияют на ее характер и направление.
Продукты реакции, в свою очередь, образуются в результате превращения эдуктов. Они представляют собой новые химические соединения, возникающие в результате обмена атомов и ионов между эдуктами.
Важно отметить, что количество эдуктов и продуктов реакции должно быть сохранено в ходе реакции. Это означает, что суммарная масса эдуктов должна равняться суммарной массе продуктов реакции.
Катализаторы и их роль в реакции синтеза
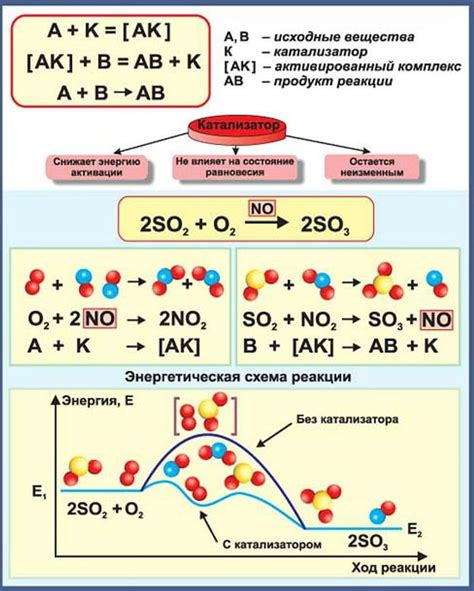
Основная функция катализаторов - активация реагентов. Они изменяют путь реакции, позволяя ей происходить при более низкой температуре и давлении. Катализаторы обладают способностью снижать энергию активации, необходимую для преодоления барьера реакции, что позволяет реагентам взаимодействовать быстрее.
Кроме того, катализаторы могут быть специфичными, то есть обладать способностью ускорять только определенные реакции или участвовать в определенном шаге реакции. Это позволяет точно регулировать синтез и получать требуемый продукт с высокой чистотой.
Катализаторы используются в широком спектре промышленных процессов синтеза, таких как производство пластмасс, удобрений, фармацевтических препаратов и многих других. Они позволяют снизить энергетические затраты, улучшить выход продукции и сократить вредные выбросы.
Кроме того, использование катализаторов часто обусловлено экономическими причинами. Они позволяют сократить затраты на сырье и снизить вероятность побочных реакций, благодаря чему можно повысить эффективность процесса синтеза.
Принципы реакции синтеза
| 1. | Принцип сохранения массы - в ходе реакции синтеза масса продуктов всегда равна сумме масс реагентов. Это значит, что ни атомы, ни молекулы не могут исчезать или появляться в ходе реакции. |
| 2. | Принцип молекулярной и атомарной взаимосвязи - процесс синтеза включает в себя разрыв и образование химических связей между атомами и молекулами. Это происходит благодаря переносу и обмену электронами. |
| 3. | Принцип энергии - реакция синтеза может быть эндотермической или экзотермической. В эндотермических реакциях энергия поглощается, что приводит к охлаждению окружающей среды. В экзотермических реакциях, наоборот, выделяется энергия, что приводит к нагреванию окружающего пространства. |
| 4. | Принцип катализа - некоторые реакции синтеза могут проходить медленно или не достигнуть полного превращения реагентов в продукты без наличия катализатора. Катализаторы ускоряют химическую реакцию, но при этом не изменяются сами. |
Изучение принципов реакции синтеза позволяет более глубоко понять механизмы и характеристики данного процесса. Эта информация важна при разработке новых методов синтеза и синтезировании различных химических соединений.
Термодинамические принципы реакции синтеза
Термодинамические принципы играют важную роль в реакциях синтеза, определяя направленность и возможность проведения химической реакции. Рассмотрим основные принципы, которые влияют на реакцию синтеза:
1. Принцип химического равновесия. Согласно этому принципу, реакция синтеза будет проходить в направлении образования продукта, если концентрация реагентов увеличивается. Но при достижении равновесия, скорости обратной и прямой реакций будут одинаковыми, и концентрация реагентов и продуктов будет постоянной.
2. Принцип энергетической состоятельности. В соответствии с этим принципом, реакция синтеза будет проходить в направлении снижения энергии системы. Если образование продукта сопровождается выделением энергии (экзотермическая реакция), то реакция будет проходить самопроизвольно. В случае поглощения энергии (эндотермическая реакция), реакция будет проходить только при наличии внешнего источника энергии.
3. Принцип энтропии. Энтропия - это мера хаоса или беспорядка в системе. Принцип энтропии предполагает, что реакция синтеза будет проходить в направлении увеличения энтропии системы. Это происходит потому, что образование новых связей вещества приводит к увеличению числа возможных микроструктур и состояний системы.
4. Принцип Гиббса. Принцип Гиббса объединяет все вышеперечисленные принципы. Согласно этому принципу, реакция синтеза будет проходить в направлении снижения свободной энергии системы (G). Если свободная энергия системы уменьшается (G
Термодинамические принципы являются основополагающими для понимания и прогнозирования реакций синтеза. Они позволяют определить, какие реакции могут проходить самопроизвольно и в каком направлении.
Кинетические принципы реакции синтеза
Реакция синтеза представляет собой процесс объединения двух или более веществ, в результате которого образуется новое вещество. Кинетические принципы реакции синтеза имеют важное значение для понимания и оптимизации данного процесса.
Скорость реакции - один из основных кинетических показателей реакции синтеза. Она определяется изменением концентрации реагентов со временем. Чем быстрее эта концентрация изменяется, тем быстрее протекает реакция.
Реакционный механизм - это последовательность этапов, которые происходят в процессе реакции синтеза. Знание реакционного механизма позволяет более точно определить скорость реакции и предсказать процесс синтеза.
Температура оказывает существенное влияние на кинетические принципы реакции синтеза. Увеличение температуры приводит к увеличению скорости реакции, поскольку оно способствует увеличению энергии молекул и их активационной энергии.
Концентрация реагентов также влияет на скорость реакции. Повышение их концентрации способствует увеличению коллизий между молекулами и, следовательно, увеличению вероятности их взаимодействия и реакции.
Катализаторы - вещества, которые ускоряют реакцию синтеза, но при этом сами не участвуют в реакции. Катализаторы изменяют механизм реакции, снижая активационную энергию и ускоряя образование нового вещества.
Определение и понимание кинетических принципов реакции синтеза играют важную роль в различных областях науки и промышленности, таких как органическая химия, фармацевтика и материаловедение. Использование этих принципов позволяет улучшать и оптимизировать процессы синтеза, что способствует созданию новых веществ и материалов.








