Относительная молекулярная масса – это величина, которая позволяет определить массу молекулы вещества относительно единицы массы. Она является одним из важных понятий в химии и используется для измерения молекулярных и атомных масс.
Относительная молекулярная масса может быть вычислена путем сложения масс атомов, составляющих молекулу вещества, с учетом их количества. Все массы атомов указываются относительно массы атома углерода-12, которая равна 12 единицам массы.
Например, водородный газ (H2) состоит из двух атомов водорода, масса каждого из которых составляет около единицы массы. Следовательно, относительная молекулярная масса водородного газа равна приблизительно 2 единицам массы.
Относительная молекулярная масса используется для различных целей. Например, она может помочь химикам определить количество вещества в реакции или вычислить процентный состав смеси. Понимание основных понятий, связанных с относительной молекулярной массой, является важным для успешного изучения химии и понимания ее основных закономерностей.
Что такое относительная молекулярная масса вещества?

Она рассчитывается путем сложения масс атомов, входящих в молекулу данного вещества. При этом масса молекулы, измеренная в атомных единицах, делится на 1/12 массы атома углерода-12. Результатом является число, которое показывает, сколько раз масса молекулы данного вещества больше массы атома углерода-12. Таким образом, относительная молекулярная масса вещества позволяет сравнивать массу различных молекул и определять их пропорции в реакциях.
Относительная молекулярная масса имеет большое значение в химии, поскольку позволяет рассчитывать количество молекул вещества по массе, знать соотношение компонентов в реакциях, определять степень чистоты вещества и проводить другие расчеты.
Пример:
Рассмотрим молекулу воды (H2O). Масса одного атома водорода равна 1 г/моль, а масса атома кислорода – 16 г/моль. Следовательно, масса одной молекулы воды будет равна:
(2 х 1 г/моль) + (1 х 16 г/моль) = 2 г/моль + 16 г/моль = 18 г/моль.
Таким образом, относительная молекулярная масса воды равна 18 атомным единицам.
Определение и значимость
Относительная молекулярная масса позволяет сравнивать массы различных молекул и анализировать химические реакции. Она является индикатором количества атомов в молекуле и значение этой величины позволяет определить структуру вещества.
Однако стоит отметить, что относительная молекулярная масса не является точной физической характеристикой вещества, так как масса молекулы может быть разной в разных условиях и при разных изотопных составах. Например, углеводороды с одинаковым числом атомов углерода, водорода и кислорода будут иметь разные молекулярные массы в зависимости от изотопного состава атомов. Поэтому для более точного описания вещества используются другие понятия, такие как абсолютная молекулярная масса и число моля.
Тем не менее, относительная молекулярная масса является популярным и удобным инструментом в химии, который широко используется в обучении и научных расчетах.
Как вычислить относительную молекулярную массу?
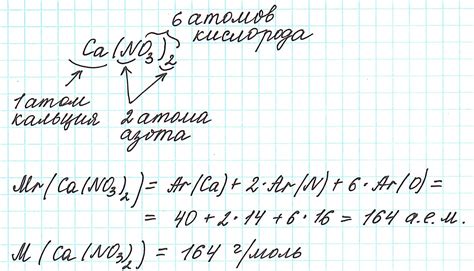
Процесс вычисления относительной молекулярной массы может быть представлен следующим алгоритмом:
- Определите формулу вещества, для которого нужно вычислить относительную молекулярную массу.
- Определите количество атомов каждого типа в формуле вещества.
- Найдите атомные массы каждого типа атомов из периодической системы элементов.
- Умножьте количество каждого типа атомов на их атомные массы и сложите результаты.
- Результат вычислений будет являться относительной молекулярной массой вещества.
Например, для вычисления относительной молекулярной массы воды (H2O) следует:
- Количество атомов водорода (H) равно 2.
- Количество атомов кислорода (O) равно 1.
- Атомная масса водорода (H) составляет 1 а.е.м., а атомная масса кислорода (O) - 16 а.е.м.
- Умножив количество атомов на атомные массы и сложив результаты получим:
Относительная молекулярная масса (M) воды = (2 * 1 а.е.м.) + (1 * 16 а.е.м.) = 18 а.е.м.
Формула и пример расчета
Относительная молекулярная масса (М) вещества вычисляется по формуле:
М = масса вещества (м) / количество вещества (n)
где:
- М - относительная молекулярная масса вещества;
- м - масса вещества в граммах;
- n - количество вещества в молях.
Например, для расчета относительной молекулярной массы воды (H2O) нужно знать массу воды и количество молей вещества. Если масса воды составляет 18 г, а количество молей вещества равно 1 моля, то:
М = 18 г / 1 моль = 18 г/моль
Таким образом, относительная молекулярная масса воды равна 18 г/моль.
Запись относительной молекулярной массы
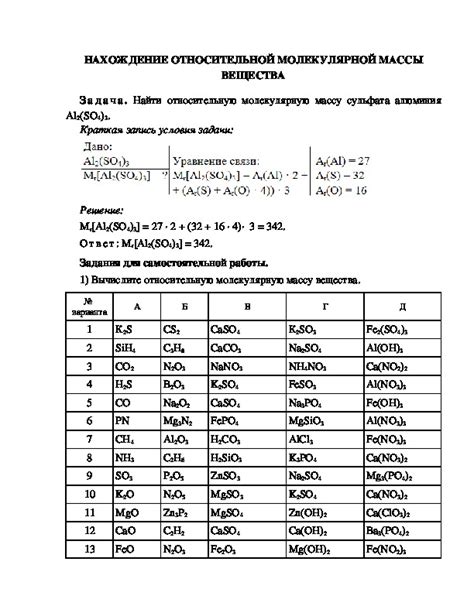
Относительная молекулярная масса обозначается символом Mр. Для записи относительной молекулярной массы вещества используется таблица элементов Менделеева. Каждый химический элемент имеет свой атомный номер, обозначающий количество протонов в ядре атома, и атомную массу, которая представляет собой сумму масс протонов и нейтронов в атоме.
Для расчета относительной молекулярной массы вещества необходимо знать состав молекулы и массу каждого атома элемента, входящего в молекулу. Затем массы атомов складываются с учетом их количества в молекуле, получая таким образом молекулярную массу вещества.
Например, для расчета относительной молекулярной массы воды (H2O), нужно знать массу атомов водорода (H) и кислорода (O). Водород имеет атомную массу около 1, а кислород - около 16. Зная, что в молекуле воды содержится два атома водорода и один атом кислорода, можно рассчитать молекулярную массу воды: (2 x 1) + 16 = 18.
Таким образом, относительная молекулярная масса воды равна 18.
Стандартное обозначение и единицы измерения
Атомная массовая единица определяется как 1/12 массы атома углерода-12. Использование атомной массовой единицы позволяет приближенно оценить массу молекулы, выраженную в относительных единицах.
При расчетах массы молекулы вещества в химических реакциях часто используются концентрации атомов или молекул. Относительная молекулярная масса позволяет определить соотношение массы компонентов в химическом веществе.
Значение относительной молекулярной массы в практике

Значение относительной молекулярной массы в практике имеет ряд применений. Во-первых, знание относительной молекулярной массы позволяет рассчитывать количество вещества, используя закономерность, известную как число Авогадро.
Например, если известна относительная молекулярная масса вещества и его масса, можно вычислить количество молекул в этой массе. Также можно вычислить количество массы вещества, используя количество молекул и относительную молекулярную массу.
Кроме того, относительная молекулярная масса используется при составлении химических уравнений, анализе реакций и определении соотношения между реагентами и продуктами.
Взаимосвязь между относительной молекулярной массой и другими показателями вещества позволяет проводить ряд расчетов и предсказывать химические свойства вещества.
Таким образом, знание относительной молекулярной массы вещества важно для практического применения химии и обеспечивает возможность проводить не только количественные, но и качественные исследования в химической науке.
Роль в химических реакциях и расчетах
Относительная молекулярная масса вещества играет важную роль в химических реакциях и расчетах, так как она позволяет определить количество вещества, участвующего в реакции, а также расчитать количество продуктов, образующихся в результате реакции.
Первый шаг в расчетах связан с определением молекулярной массы вещества. Зная молекулярную формулу вещества, можно найти молекулярную массу, складывая массы атомов, из которых состоит молекула. Для этого нужно использовать периодическую систему элементов и найти атомные массы элементов, умножив их на количество данного элемента в молекуле и сложив все полученные значения.
Зная молекулярную массу вещества, можно расчитать количество вещества в граммах, используя формулу:
количество вещества = масса / молекулярная масса
Для расчета количества продуктов реакции, образующихся в результате химической реакции, нужно использовать пропорцию между коэффициентами стехиометрических уравнений и количествами вещества. Например, если дано количество вещества одного вещества, можно использовать коэффициенты стехиометрического уравнения, чтобы определить количество другого вещества, участвующего в реакции.
Таким образом, относительная молекулярная масса вещества является важной величиной, которая используется для расчетов в химических реакциях и позволяет определить степень превращения веществ в процессе реакции и количество продуктов, образующихся в результате данной реакции.
Отличие относительной молекулярной массы от молярной массы

Относительная молекулярная масса обозначает отношение массы молекулы вещества к единице массы атома-углерода. Обычно выражается в безразмерных единицах, т.к. масса молекулы вещества выражается относительно массы молекулы атома-углерода, которая равна приблизительно 12 единиц атомной массы. Относительная молекулярная масса позволяет определить, сколько раз масса молекулы вещества больше массы одного атома углерода.
Молярная масса, с другой стороны, обозначает массу одного моля вещества и измеряется в граммах на один моль (г/моль). Она является числовым значением, которое можно найти в периодической системе химических элементов. Молярная масса позволяет вычислить массу вещества по известному количеству вещества, выраженному в молях, и наоборот.
Таким образом, отличие между относительной молекулярной массой и молярной массой заключается в их определениях и единицах измерения. Относительная молекулярная масса определяет отношение массы молекулы к единице массы атома-углерода, тогда как молярная масса определяет массу одного моля вещества в граммах.
Определение и примеры различий
В химии существует несколько понятий, связанных с относительной молекулярной массой, которые иногда могут вызвать путаницу. Однако, несмотря на некоторые сходства, они имеют различные значения и используются в разных контекстах.
Рассмотрим главные различия между относительной молекулярной массой и другими подобными понятиями:
| Понятие | Значение | Пример |
|---|---|---|
| Атомная масса | Масса одного атома вещества | Масса атома водорода составляет примерно 1 г/моль |
| Молекулярная масса | Масса одной молекулы вещества | Молекулярная масса воды (H₂O) равна 18 г/моль |
| Молярная масса | Масса одного моля вещества | Молярная масса кислорода (O₂) составляет примерно 32 г/моль |
| Относительная молекулярная масса | Сумма относительных атомных масс атомов в молекуле | Относительная молекулярная масса глюкозы (C₆H₁₂O₆) равна 180 г/моль |
Эти понятия позволяют определить массу вещества и проводить различные вычисления в химических реакциях. Например, зная относительную молекулярную массу вещества, можно определить, сколько массы данного вещества содержится в определенном количестве (например, в одной моль) данного вещества.
Таким образом, различия между относительной молекулярной массой и другими понятиями позволяют более точно описывать состав и свойства вещества, а также проводить различные химические расчеты. Важно четко понимать эти различия, чтобы использовать соответствующие понятия в нужном контексте.
Примеры вычисления относительной молекулярной массы

Относительная молекулярная масса вещества вычисляется путем сложения масс атомов, входящих в его молекулу. Рассмотрим несколько примеров расчета относительной молекулярной массы.
| Вещество | Молекулярная формула | Состав | Масса атомов | Относительная молекулярная масса |
|---|---|---|---|---|
| Вода | H2O | 2 атома водорода, 1 атом кислорода | 1.008 г/моль, 16.00 г/моль | 18.02 г/моль |
| Углекислый газ | CO2 | 1 атом углерода, 2 атома кислорода | 12.01 г/моль, 16.00 г/моль | 44.01 г/моль |
| Метан | CH4 | 1 атом углерода, 4 атома водорода | 12.01 г/моль, 1.008 г/моль | 16.04 г/моль |
Приведенные примеры демонстрируют, как с помощью масс атомов, входящих в молекулу вещества, можно рассчитать его относительную молекулярную массу. Это важное понятие в химии, которое позволяет проводить различные расчеты и определять свойства веществ.








