Относительная атомная масса элемента - это числовая характеристика, которая показывает, насколько раз атом выбранного элемента тяжелее атома водорода. Эта величина является основным показателем массы атома и определяет, насколько элементы различаются по своей атомной массе. Понимание относительной атомной массы элемента является важным для понимания его химических свойств и реакций.
Относительная атомная масса элемента выражается в атомных единицах массы (указующих на 1/12 массы атома углерода -12). Например, относительная атомная масса кислорода равна 16, а относительная атомная масса железа равна 56. Надо отметить, что обычно относительная атомная масса элемента является нецелым числом, так как она учитывает все изотопы, существующие природно.
Знание относительной атомной массы элемента имеет множество важных применений в химии и физике. Она используется для расчета молекулярных масс, состава химических соединений и стоимости вещества. Кроме того, относительная атомная масса элемента является важным параметром в многих химических и физических формулах и уравнениях.
Таким образом, понимание относительной атомной массы элемента является фундаментальным для изучения химии и имеет значительное влияние на практические применения в различных областях науки и технологии.
Определение относительной атомной массы
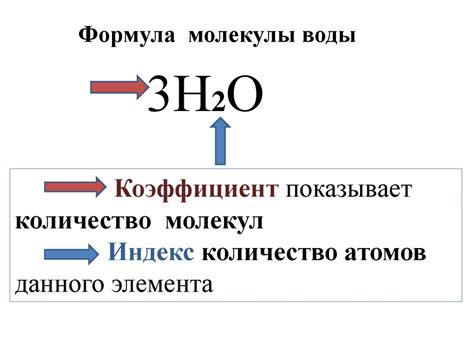
Для определения относительной атомной массы элемента необходимо знать массу всех его изотопов и их относительную частоту в природе. Относительная частота изотопов элемента зависит от их стабильности, а также процессов, происходящих в природе, таких как радиоактивный распад и ядерные реакции.
Относительная атомная масса элемента вычисляется по формуле:
| Mass element = (Mass 1 x % abundance 1) + (Mass 2 x % abundance 2) + ... |
|---|
Где "Mass element" - относительная атомная масса элемента, "Mass 1, Mass 2, ..." - массы изотопов элемента, "% abundance 1, % abundance 2, ..." - относительные частоты изотопов в природе.
Относительная атомная масса элемента играет важную роль в химии и физике. Она используется для расчетов химических реакций, определении молекулярных и атомных масс соединений, а также для определения концентрации веществ в разных средах.
Молярная масса элемента
Молярная масса является важной величиной в химии, так как она позволяет выполнять различные расчеты и прогнозировать результаты химических реакций. Зная молярную массу элемента, можно определить количество вещества в граммах или молях, а также рассчитать массовую долю элемента в составе соединений.
Для расчета молярной массы элемента необходимо знать атомную массу каждого его изотопа и их относительные доли. Атомная масса изотопа - это средняя масса атомов данного элемента, учитывая их пропорции в природе.
| Элемент | Относительная атомная масса |
|---|---|
| Водород | 1.008 г/моль |
| Кислород | 16.00 г/моль |
| Углерод | 12.01 г/моль |
В таблице приведены примеры относительных атомных масс для некоторых элементов. Они могут быть использованы для расчетов молярной массы вещества, содержащего данные элементы.
Значение относительной атомной массы

Знание относительной атомной массы элемента является важным в химии и физике. Она используется для расчета массы вещества при известной количественной составляющей и установлении соотношения между массой и количеством вещества при проведении химических реакций и решении различных задач химического анализа.
Кроме того, относительная атомная масса элемента является важным параметром при составлении химических уравнений, решении стехиометрических задач и определении соотношения между массой и объемом вещества при решении задач физической химии.
Относительная атомная масса элемента также является основой для определения молярной массы вещества, которая позволяет связать количественные (массу, количество вещества) и объемные (концентрацию) характеристики вещества.
Таким образом, знание относительной атомной массы элемента является фундаментальным для понимания и изучения химических и физических процессов, а также для решения задач в химии и физике.
Использование относительной атомной массы в химии
Однако относительная атомная масса необходима не только для обозначения массы отдельных атомов, но и для определения молекулярной массы различных соединений. Молекулярная масса вычисляется путем сложения относительных атомных масс составляющих элементов, умноженных на их количество в молекуле.
Относительная атомная масса является ключевым показателем при проведении химических реакций, так как она позволяет определить количество вещества, участвующего в реакции, и оценить результаты превращения одних веществ в другие.
Также относительная атомная масса играет важную роль при изучении и классификации элементов. Сравнивая относительные атомные массы элементов, можно определить их принадлежность к разным группам и периодам периодической системы элементов. Более тяжелые элементы обычно имеют большую относительную атомную массу, чем легкие.
| Элемент | Символ | Относительная атомная масса |
|---|---|---|
| Водород | H | 1,008 |
| Кислород | O | 16,00 |
| Углерод | C | 12,01 |
| Азот | N | 14,01 |
В приведенной таблице приведены значения относительной атомной массы некоторых элементов. Эти значения могут варьироваться с точностью до нескольких десятитысячных. Точность измерения относительной атомной массы является важным фактором при проведении различных химических расчетов и экспериментов.
Относительная атомная масса и изотопы
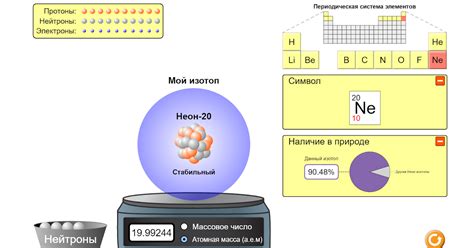
Изотопы - это атомы одного и того же элемента, но имеющие разное количество нейтронов в ядре. Изотопы имеют одинаковое количество протонов и электронов, но разные массы. Это обуславливает различия в относительных атомных массах элементов с одинаковым атомным номером.
Относительная атомная масса элемента рассчитывается как среднее значение массы всех его изотопов, учитывая их процентное содержание. Например, углерод имеет три изотопа - углерод-12, углерод-13 и углерод-14. В природе наиболее распространен углерод-12, который составляет около 99% всех атомов углерода. Углерод-13 составляет около 1%, а углерод-14 - менее 0,01%. Следовательно, относительная атомная масса углерода будет близка к 12,01 у.
Знание относительной атомной массы элемента является важным для проведения химических расчетов, таких как расчеты молей и массы вещества. Она также помогает определить пропорции элементов в соединении и предсказать его физические и химические свойства.
Относительная атомная масса и международная система единиц
Относительная атомная масса элемента является важным показателем в химии и физике. Она используется для расчета массы вещества в различных химических реакциях, а также для определения количества вещества, выраженного в молях.
Относительная атомная масса элемента указывается в таблице Менделеева и в других справочниках химических данных. Значение относительной атомной массы элемента может быть десятичным числом, так как оно учитывает изотопический состав элемента и массы его изотопов в естественном образце.
Международная система единиц (СИ) также использует относительную атомную массу. В СИ масса измеряется в килограммах (кг), однако для элементов, атомных и молекулярных масс используется единица измерения – атомная массовая единица (аму). 1 аму равна одной двенадцатой от массы атома углерода-12. Таким образом, в Международной системе единиц относительная атомная масса элемента измеряется в атомных массовых единицах.
Определение относительной атомной массы на практике

Определение относительной атомной массы на практике включает несколько шагов. Во-первых, необходимо собрать информацию о массовых числах и относительных обилиях изотопов данного элемента из различных источников.
Затем производится вычисление относительной атомной массы. Для этого каждое массовое число изотопа умножается на его относительное обилие в процентах, затем полученные значения суммируются.
Например, для элемента кислорода известны два изотопа - кислород-16 (обилие 99,757 %) и кислород-18 (обилие 0,205 %). Вычисление относительной атомной массы будет выглядеть следующим образом:
(16 * 99,757) + (18 * 0,205) = 15,994
Таким образом, относительная атомная масса кислорода составляет примерно 15,994 удельных единиц относительно массы атома углерода-12.
Знание относительных атомных масс элементов позволяет проводить различные расчеты в химических реакциях, определять концентрации веществ в растворах и многое другое. Поэтому понимание того, что такое относительная атомная масса и умение ее определить на практике, являются важными навыками для химиков и студентов, изучающих химию.








