Существуют множество химических реакций, которые происходят в нашей повседневной жизни. Однако, реакции можно разделить на два основных типа: обратимые и необратимые. Каждый тип реакции имеет свои особенности и играет важную роль в понимании и изучении химии.
Обратимая реакция - это такая реакция, которая может проходить в обоих направлениях. Это означает, что исходные вещества могут превращаться в продукты реакции, но также продукты реакции могут восстановиться обратно в исходные вещества. Обратимая реакция характеризуется равновесием, где скорость прямой и обратной реакции одинакова.
Например, растворение соли в воде - это обратимая реакция. Соли могут раствориться в воде, образуя ионы, но эти ионы также могут снова соединиться и образовать исходное вещество - соль. Обратимые реакции могут происходить в различных условиях, таких как изменение температуры, концентрации или давления.
Невозможно не упомянуть необратимые реакции. Необратимая реакция - это такая реакция, которая происходит только в одном направлении и не может переходить обратно в исходные вещества. В этом случае, исходные вещества полностью превращаются в новые продукты реакции и не могут восстановиться в исходное состояние.
Примером необратимой реакции может быть горение бумаги. Когда бумага загорается, она окисляется при контакте с кислородом и сгорает, образуя углекислый газ и другие вещества. Процесс горения бумаги не может быть обращен назад и исходная бумага не может быть восстановлена.
Обратимая реакция и ее значение
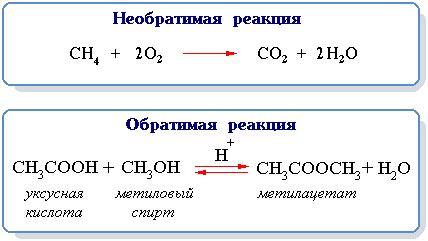
В обратимых реакциях все реагенты и продукты реакции находятся в равновесии, то есть концентрации их остаются постоянными со временем. Это связано с тем, что скорость прямой реакции равна скорости обратной реакции, и таким образом, система находится в равновесии.
Обратимая реакция имеет большое значение для понимания химических реакций. Она позволяет ученым предсказывать, какие реагенты и условия требуются для достижения равновесия реакции. Кроме того, обратимая реакция позволяет контролировать превращение реагентов в продукты и наоборот, что может быть полезно в различных процессах и при производстве различных химических веществ.
| Примеры обратимых реакций | Примеры необратимых реакций |
|---|---|
| Реакция образования воды: H2 + O2 => H2O | Сгорание бумаги: бумага + кислород => углекислый газ + вода |
| Реакция диссоциации кислоты: HCl => H+ + Cl- | Реакция горения металла: металл + кислород => металлический оксид |
Как видно из приведенных примеров, обратимые реакции обычно включают в себя молекулы, которые могут связываться или распадаться, а необратимые реакции обычно включают в себя реагенты, превращающиеся в продукты без возможности обратного превращения. Обратимая реакция является фундаментальным понятием в химии и помогает объяснить множество химических процессов, происходящих в естественных и искусственных системах.
Что такое обратимая реакция и как она работает
Обратимая реакция обычно происходит в замкнутой системе, где все реагенты и продукты остаются в пределах этой системы. При этом, хотя сама реакция может быть обратимой, равновесие между начальными и конечными состояниями может быть достигнуто только в определенных условиях.
Обратимые реакции могут быть представлены в виде химических уравнений, где стрелка в обе стороны указывает на возможность реакции и в обратном направлении. Например, водород и кислород могут реагировать между собой, чтобы образовать воду, но вода также может обратно распадаться на водород и кислород.
Работа обратимой реакции основана на принципе химического равновесия. В системе, где происходит обратимая реакция, установится равновесие между начальными и конечными состояниями. Причины, которые могут повлиять на смещение равновесия в одну или другую сторону, включают изменение концентраций реагентов и продуктов, изменение температуры и давления, а также использование катализаторов.
Обратимые реакции имеют большую значимость в химическом процессе и химической промышленности. Они позволяют достигнуть максимального выхода продукта, так как начальные вещества, не преобразующиеся полностью, могут быть возвращены в реакцию для дальнейшего превращения. Также, обратимые реакции играют важную роль в поддержании химического равновесия в организме живых организмов и в природе в целом.
Необратимая реакция и ее значение

Необратимые реакции могут протекать под воздействием высоких температур, давления или катализаторов, которые активируют химические реакции и делают их необратимыми. Такие реакции могут играть важную роль в промышленном производстве, при производстве химических веществ или при получении энергии.
Значение необратимых реакций заключается в их практической применимости. Они позволяют получать новые продукты, улучшать процессы производства и обеспечивать необходимую энергию. Применение необратимых реакций в различных отраслях промышленности позволяет расширять возможности производства и создавать новые материалы и продукты.
| Примеры необратимых реакций | Значение |
|---|---|
| Сжигание угля | Получение энергии |
| Плавление металлов | Получение материалов для производства |
| Химическое окисление | Получение новых веществ |
Необратимая реакция является противоположностью обратимой реакции, в которой реагенты могут превращаться в продукты и обратно. Обратимые реакции в основном проходят при низких температурах и без катализаторов. Они играют важную роль в биохимических процессах в организмах живых существ и позволяют поддерживать равновесие концентрации веществ в клетках.
В общем, необратимая реакция имеет большое значение в химии и промышленности, она открывает новые возможности для производства и получения необходимых продуктов и материалов.
Что представляет собой необратимая реакция и в чем ее отличие от обратимой
Отличия необратимой реакции от обратимой заключаются в следующем:
1. Прогресс реакции: В необратимой реакции реакция продолжается до полного расхода реагентов и образования окончательных продуктов. В обратимой реакции образуются продукты, но они могут вновь реагировать и превращаться обратно в исходные реагенты.
2. Изменение концентраций компонентов: В необратимой реакции концентрации реагентов с течением времени уменьшаются, тогда как концентрации продуктов растут. В обратимой реакции концентрации реагентов и продуктов остаются постоянными, устанавливаясь на равновесие.
3. Энергия активации: В необратимой реакции энергия активации является значительно меньшей, по сравнению с обратимой реакцией. Это означает, что необратимая реакция происходит с большей скоростью, чем обратимая.
4. Изменение направленности: В необратимой реакции продукты не могут обратно превратиться в реагенты без внешнего вмешательства. В обратимой реакции направление реакции может быть изменено путем изменения условий, таких как температура или концентрация реагентов.
Таким образом, необратимая реакция является окончательной и непрерывной, в то время как обратимая реакция может двигаться в обоих направлениях и имеет потенциал для равновесия.
Основные характеристики обратимой и необратимой реакции

Важной особенностью обратимой реакции является наличие равновесия. Реакция протекает в обе стороны, поэтому концентрации продуктов и реагентов остаются постоянными, но могут изменяться в зависимости от изменения условий.
Необратимая реакция, в отличие от обратимой, идет только в одном направлении и не может вернуться к исходным реагентам без внесения дополнительных изменений в систему. Продукты необратимой реакции нельзя превратить обратно в реагенты.
Необратимые реакции обычно проходят с выделением энергии в виде тепла или света, примерами таких реакций являются сгорание, окисление, нейтрализация.
Наиболее распространенные примеры обратимых реакций - реакции растворения или гидролиза, ионизация кислот и щелочей, реакции равновесия, такие как образование воды из водорода и кислорода.
Обратимые и необратимые реакции имеют различные практические и промышленные применения. Понимание и управление данными типами химических реакций играет важную роль в различных областях, включая производство лекарств, производство пластиков и пищевую промышленность.








