Система периодического закона Д.И. Менделеева позволяет организовать химические элементы в таблицу, в которой соседние элементы схожи по своим химическим свойствам. Организация элементов основана на их электронной конфигурации внешних электронных оболочек. Каждому элементу в таблице соответствует уникальный номер группы, который играет важную роль в определении химических свойств элемента.
Особый интерес представляют элементы главной подгруппы, то есть элементы, у которых номер группы от 1 до 18. В отличие от элементов побочных подгрупп (с номерами групп 3-12), которые называются переходными металлами, элементы главной подгруппы обладают более простой химической природой и обобщенными химическими свойствами. Это делает элементы главной подгруппы основой для понимания более сложных и разнообразных химических реакций и соединений.
Важно понимать, что номер группы для элементов главной подгруппы указывает на число электронов во внешней электронной оболочке элемента. Например, у элементов группы 1 (щелочные металлы) внешняя оболочка содержит 1 электрон; у элементов группы 2 (щелочноземельные металлы) - 2 электрона; у элементов группы 17 (галогены) - 7 электронов. Это число электронов является определяющим фактором при химическом взаимодействии элементов.
Давайте рассмотрим примеры. Элементы группы 1 имеют одну электрон во внешней оболочке, что делает их очень реактивными и представляющими большой интерес с точки зрения химических реакций. Натрий (Na) и калий (K) являются элементами этой группы и легко реагируют с водой, выделяя горючий водород. Элементы группы 2 имеют 2 электрона во внешней оболочке и также обладают высокой реактивностью, но уже не такой высокой, как элементы группы 1.
Важно отметить, что для элементов главной подгруппы номер группы также определяет количество энергии, которое требуется для удаления электрона из внешней оболочки. Чем выше номер группы, тем меньше энергии нужно для отделения электрона.
Номера группы элементов
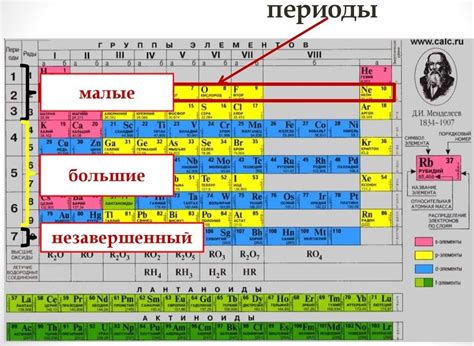
Каждый элемент имеет свой уникальный атомный номер, который определяет его положение в таблице Менделеева. Также у элементов есть номер группы, который указывает на их химическое свойство и определенные особенности. Номер группы элементов в основном действует как индикатор таких свойств, как валентность и электронная конфигурация.
Особое значение имеет номер группы для элементов главной подгруппы – это второй номер, написанный над химическим символом элемента. Номер группы дает информацию о количестве внешних электронов, а следовательно, о валентности элемента. Важно отметить, что номера группы элементов могут быть различными для элементов в главной подгруппе и элементов в подгруппе параметрического ряда.
Примеры:
- Углерод (C) находится во второй группе главной подгруппы, поэтому его номер группы равен 14. Это означает, что углерод имеет 4 внешних электрона и его валентность равна 4.
- Кислород (O) находится в шестой группе главной подгруппы и имеет номер группы 16. У кислорода также 6 внешних электронов, поэтому его валентность также равна 6.
- Натрий (Na) находится в первой группе главной подгруппы и имеет номер группы 11. У натрия всего 1 внешний электрон, поэтому его валентность равна 1.
Таким образом, номер группы элементов, особенно для элементов главной подгруппы, играет важную роль в определении их свойств и валентности. Он помогает удобно идентифицировать и классифицировать элементы в таблице Менделеева.
Значение номера группы в таблице Менделеева
В таблице Менделеева номер группы указывает на количество внешних электронов в атоме элемента. Группы в таблице Менделеева разделены на блоки s, p, d и f. Каждый блок имеет свою характеристику.
Группы 1 и 2 относятся к блоку s, атомы которого содержат 1 или 2 внешних электрона соответственно. Атомы этих элементов обладают сильными щелочными свойствами и легко отдают эти электроны при реакциях.
Группы 13-18 относятся к блоку p, атомы которого содержат от 3 до 8 внешних электронов. Элементы этого блока имеют различные химические свойства. Например, группа 17 содержит галогены, такие как хлор и фтор, которые обладают сильными окислительными свойствами.
Блоки d и f содержат переходные элементы. Переходные элементы блока d находятся с 3-го по 12-й группы и включают элементы, имеющие от 1 до 10 внешних электронов. Эти элементы обладают различными химическими свойствами и широко используются в промышленности и технологии.
Блок f содержит элементы, расположенные в нижней части таблицы Менделеева. Они относятся к лантанидам и актинидам и имеют сложные химические свойства.
Знание номера группы позволяет предсказать основные химические свойства элемента и его поведение в химических реакциях. Это облегчает изучение и понимание свойств различных элементов в химии и других науках, где используется таблица Менделеева.
Роль номера группы в химической реакции
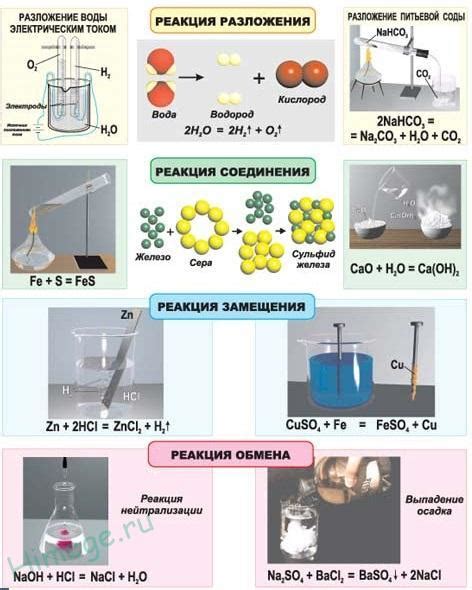
Номер группы химического элемента играет важную роль в химической реакции. Он обозначает различные свойства элемента и его способность взаимодействовать с другими элементами. У каждой группы есть свои характеристики, которые могут влиять на химический процесс.
Например, элементы группы 1, такие как литий (Li) и калий (K), имеют один электрон во внешней оболочке и склонны отдавать его, образуя положительные ионы. Это делает их хорошими разъединителями, и они часто используются в промышленных процессах, таких как производство щелочей.
На другом конце спектра находятся элементы группы 18, такие как неон (Ne) и аргон (Ar). Они имеют полностью заполненные внешние оболочки электронов и не образуют ионов. Это делает их химически стабильными и практически нереактивными.
Номер группы также может указывать на способность элемента образовывать определенные соединения. Например, элементы группы 17, хлор (Cl) и фтор (F), имеют семь электронов во внешней оболочке и склонны принимать один электрон, образуя отрицательные ионы. Они образуют связи с элементами группы 1, чтобы достичь электронной стабильности.
Таким образом, номер группы элемента предоставляет информацию о его активности и возможности взаимодействия с другими элементами в химической реакции.
| Группа | Примеры элементов | Свойства и реактивность |
|---|---|---|
| 1 | Li, Na, K | Отдают электрон, образуют ионы |
| 18 | Ne, Ar | Не образуют ионы, химически стабильны |
| 17 | Cl, F | Принимают электрон, образуют отрицательные ионы |
Влияние номера группы на свойства элементов
Номер группы в периодической системе химических элементов играет значительную роль в определении их свойств. Это связано с тем, что номер группы определяет количество валентных электронов элемента. Валентные электроны находятся на самом внешнем энергетическом уровне и отвечают за химическую активность элемента.
Как правило, элементы из одной группы имеют схожие химические свойства, так как они имеют одинаковое количество валентных электронов. Например, элементы первой группы, или щелочные металлы, имеют один валентный электрон и обладают высокой активностью. Элементы второй группы, или щелочноземельные металлы, имеют два валентных электрона и также проявляют схожие химические свойства.
Однако, с увеличением номера группы, изменяются и свойства элементов. Например, элементы пятой группы, или азотные элементы, имеют пять валентных электронов и обладают разнообразной химической активностью. Элементы шестой группы, или кислородные элементы, имеют шесть валентных электронов и также проявляют свои характерные свойства.
Таким образом, номер группы является важным фактором, определяющим свойства элементов. Благодаря этому, можно классифицировать элементы и предсказывать их химическое поведение. Знание влияния номера группы позволяет ученым разрабатывать новые соединения и материалы в различных областях науки и промышленности.








