Углеводороды – это органические соединения, состоящие из атомов углерода и водорода. Они являются одной из основных групп химических соединений и играют важную роль в природе и промышленности. Предельные и непредельные углеводороды – это две основные категории углеводородов, которые отличаются по своей структуре и свойствам.
Предельные углеводороды, также известные как алканы, представляют собой простейшие углеводороды, состоящие только из атомов углерода и водорода, связанных одинарными химическими связями.
Примеры предельных углеводородов: метан, этан, пропан, бутан и др.
В отличие от предельных углеводородов, непредельные углеводороды содержат двойные или тройные химические связи между атомами углерода, что делает их более активными и реакционноспособными.
Примеры непредельных углеводородов: этилен, пропилен, ацетилен и др.
Основное отличие между предельными и непредельными углеводородами заключается в том, что предельные углеводороды обладают только одинарными химическими связями между атомами углерода, тогда как непредельные углеводороды имеют двойные или тройные химические связи. Это различие в структуре влияет на их физические и химические свойства, например, точку кипения, плотность и реакционную способность.
Состав и строение предельных углеводородов

Строение предельных углеводородов можно описать как линейную цепь углеродных атомов, на которые непосредственно связаны атомы водорода. Например, пропан (C3H8) – это пример предельного углеводорода с тремя атомами углерода. Его структуру можно представить в виде прямой цепи из трёх углеродных атомов, на которые связаны восемь атомов водорода.
| Название | Молекулярная формула | Структурная формула |
|---|---|---|
| Метан | CH4 |  |
| Этан | C2H6 |  |
| Пропан | C3H8 |  |
Одной из ключевых особенностей предельных углеводородов является их насыщенность. У одной молекулы предельного углеводорода число связей атомов углерода с атомами водорода равно числу доступных связей. Это делает их наиболее стабильными и менее реакционноспособными по сравнению с другими классами углеводородов.
Особенности строения непредельных углеводородов
Особенностью строения непредельных углеводородов является наличие "незанятых" свалок радикалов. Это означает, что углеродные атомы в непредельных углеводородах имеют возможность образования связей с другими атомами или группами атомов, что делает эти соединения более активными и реакционноспособными.
Непредельные углеводороды также могут содержать функциональные группы, такие как амины, альдегиды, кетоны и кислородсодержащие группы, которые придают им специфические свойства и реакционную активность.
Примерами непредельных углеводородов являются алкены (углеводороды с двойными связями) и алкины (углеводороды с тройными связями). Эти соединения играют важную роль в органической химии и имеют множество промышленных и биологических применений.
Различия в формулах предельных и непредельных углеводородов
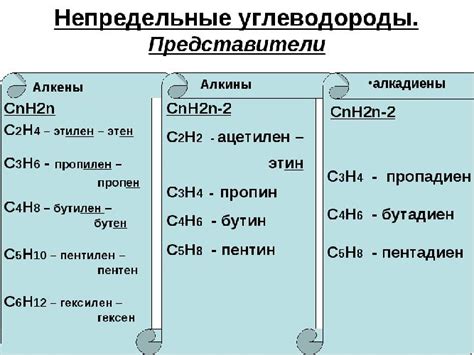
Предельные углеводороды, также известные как насыщенные углеводороды, представляют собой соединения, содержащие только одинарные связи между атомами углерода. Формула таких углеводородов имеет вид CnH2n+2, где n представляет число углеродных атомов в молекуле. Примеры предельных углеводородов включают метан (CH4), этан (C2H6) и пропан (C3H8).
Непредельные углеводороды, или неса
Физические свойства предельных углеводородов
Одним из основных физических свойств предельных углеводородов является их плавкость и кипение. Порядок следования алканов в ряду определяется числом атомов углерода в их молекуле. С увеличением числа углеродных атомов, как правило, повышается температура плавления и кипения алканов. К примеру, метан - самый простой алкан, обладает очень низкой температурой плавления и кипения (-182,5°С и -161,5°С соответственно), в то время как пентан, с пятью углеродами в молекуле, имеет температуру плавления и кипения уже равные 43°С и 36°С соответственно.
Предельные углеводороды обладают также слабой полярностью, так как у них отсутствуют функциональные группы или двойные и тройные связи. Это влияет на их растворимость в различных средах. Алканы обычно плохо растворимы в воде, так как водные молекулы имеют сильные межмолекулярные взаимодействия, основанные на водородных связях. В то же время, алканы легко растворяются в неполярных растворителях, таких как бензол или гексан, благодаря слабым ван-дер-ваальсовым силам.
Кроме того, предельные углеводороды обладают низкой плотностью, благодаря относительно небольшой массе и размерам молекул. Это делает их легкими и подвижными, что дает возможность им легко испаряться и сгорать, образуя воду и углекислый газ.
Таким образом, физические свойства предельных углеводородов связаны с их молекулярной структурой и межмолекулярными взаимодействиями, в основном слабыми ван-дер-ваальсовыми силами. Понимание этих свойств помогает в изучении и применении алканов в различных областях, таких как химическая промышленность, энергетика и медицина.
Физические свойства непредельных углеводородов

Физические свойства непредельных углеводородов существенно отличаются от предельных углеводородов.
Одним из основных свойств непредельных углеводородов является их неполярность. В силу наличия двойной или тройной связи, эти углеводороды обладают высокой степенью насыщенности электронами, что делает их неполярными молекулами.
Также, из-за наличия несокетных связей, непредельные углеводороды обладают более высокими температурами кипения по сравнению с предельными углеводородами. Это связано с большей сложностью образования межмолекулярных связей и повышением сил притяжения между молекулами.
Химические свойства предельных углеводородов
Одним из основных химических свойств предельных углеводородов является их низкая активность. Это связано с насыщенностью их молекулы связями только одинарного типа. Такая структура делает алканы менее реакционноспособными по сравнению с углеводородами, содержащими двойные или тройные связи. Они мало подвержены химическим реакциям и обладают высокой устойчивостью к разрушению.
Однако наличие одинарных связей в молекуле алканов не означает полное отсутствие реакционной активности. Алканы могут подвергаться процессам горения, окисления и дегидрирования. Также они могут подвергаться хлорированию, бромированию и другим видам галогенирования. Одним из способов функционализации алканов является каталитическое гидрирование, при котором включение водорода позволяет получить соответствующие алкены или алкоголи.
У алканов также есть специфические химические свойства, которые определяются наличием различных функциональных групп. Например, алканы с короткими углеродными цепями (до 4 атомов углерода) обладают большей летучестью и могут использоваться в качестве топлива. Алканы с длинными цепями имеют более высокую температуру кипения и могут применяться в качестве смазочных материалов и пластичных веществ.
| Свойство | Описание |
|---|---|
| Горение | Предельные углеводороды горят в присутствии кислорода, образуя воду и углекислый газ. Реакция горения алканов является экзотермической и сопровождается выделением большого количества тепла. |
| Окисление | Алканы могут подвергаться окислительным реакциям, при которых образуются соответствующие алкены и алкоголи. Окисление алканов может происходить под действием химических реагентов или при участии ферментов. |
| Дегидрирование | При нагревании алканов в присутствии катализаторов, они могут терять молекулы воды и образовывать соответствующие алкены. Дегидрирование используется в промышленности для получения определенных видов углеводородов. |
В целом, предельные углеводороды обладают невысокой реакционной активностью, но имеют ряд химических свойств, позволяющих использовать их в различных процессах и промышленных приложениях.








