Оксиды - это химические вещества, состоящие из соединения кислорода с другими элементами. Они играют важную роль в нашей жизни и в химической промышленности. Мы встречаемся с оксидами, каждый день, дышим воздухом, берём кислород атомов в свои легкие.
Существует множество оксидов с различными формулами. Некоторые из них являются основными веществами, которые изучаются в школе и колледже, другие широко используются в промышленности и в нашей повседневной жизни. Мы рассмотрим некоторые из наиболее известных оксидов и их формулы.
CO2 - углекислый газ, который отделяется при дыхании людей. Это один из главных компонентов атмосферы Земли и используется в пищевой промышленности (например, для газированных напитков).
SO2 - диоксид серы, который образуется при сгорании топлива и отходит от промышленных предприятий. Он является причиной кислотного дождя и вредит растительности и животному миру.
H2O - вода, один из самых распространенных оксидов. Она является жизненно важной для всех организмов и используется во многих промышленных процессах.
Fe2O3 - оксид железа, также известный как ржавчина. Он является основным составным элементом ржавых предметов.
Это только небольшой список оксидов, чьи формулы полезно знать. Оксиды имеют разнообразные свойства и широко используются в различных сферах. Изучение этих соединений позволяет лучше понять мир химии и его влияние на нашу жизнь.
Оксиды переходных металлов
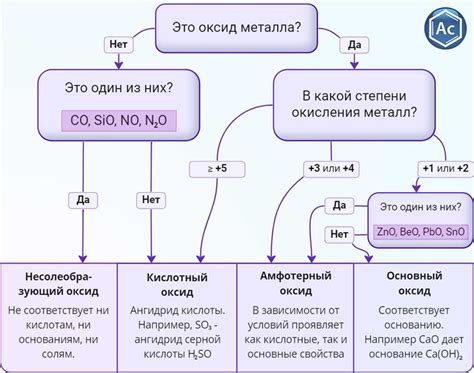
Оксиды переходных металлов могут иметь различные степени окисления, что влияет на их свойства и возможности применения. Некоторые из наиболее важных оксидов переходных металлов включают в себя:
| Название оксида | Формула |
|---|---|
| Оксид железа(II) | FeO |
| Оксид железа(III) | Fe2O3 |
| Оксид марганца(IV) | MnO2 |
| Оксид меди(II) | CuO |
| Оксид никеля(II) | NiO |
| Оксид кобальта(II) | CoO |
| Оксид титана(IV) | TiO2 |
| Оксид хрома(III) | Cr2O3 |
Это лишь некоторые примеры оксидов переходных металлов, а также есть множество других оксидов, формулы которых необходимо знать для понимания и изучения химии.
Оксиды переходных металлов обладают различными физическими и химическими свойствами, их использование широко разнообразно. Например, оксид железа(III) является одним из основных компонентов ржавчины и используется в производстве металлов и красок.
Оксиды переходных металлов играют важную роль в различных процессах и являются важными соединениями в химической промышленности.
Оксиды щелочных металлов
Оксиды щелочных металлов характеризуются высокой щелочностью, то есть они образуют щелочные растворы при взаимодействии с водой. Они также обладают высокой электропроводностью и способностью образовывать соли при реакции с кислотами.
Список основных оксидов щелочных металлов:
Оксид лития (Li2O) - образует сильно щелочные растворы, используется в производстве литиевых батарей и стекол.
Оксид натрия (Na2O) - образует щелочные растворы, используется в производстве стекла, щелочей и мыла.
Оксид калия (K2O) - образует сильно щелочные растворы, используется в производстве щелочей, стекол и кормовых добавок.
Оксид рубидия (Rb2O) - обладает свойствами щелочи и используется в производстве специальных стекол и керамики.
Оксид цезия (Cs2O) - сильно щелочной оксид, используется в производстве электрических аккумуляторов и других электронных устройств.
Оксиды щелочных металлов также широко используются в химической промышленности, медицине и других отраслях науки и техники.
Оксиды щелочноземельных металлов
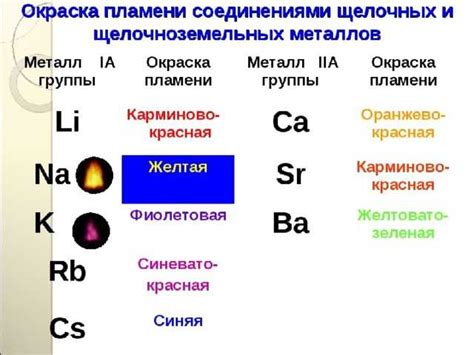
Оксиды щелочноземельных металлов обладают общей формулой MO, где M представляет собой щелочноземельный металл, такой как бериллий (Be), магний (Mg), кальций (Ca), стронций (Sr) или барий (Ba).
Ниже приведены некоторые из основных оксидов щелочноземельных металлов:
Бериллий оксид (BeO): Бериллий оксид имеет формулу BeO. Он является белым порошком и химически инертен. Бериллий оксид широко используется в производстве керамики, электроники и в других отраслях промышленности.
Магниевый оксид (MgO): Магниевый оксид имеет формулу MgO. Он является белым порошком и обладает высокой температурной стабильностью. Магниевый оксид используется в производстве огнеупорных материалов, цемента и лекарственных препаратов.
Кальциевый оксид (CaO): Кальциевый оксид, также известный как известь, имеет формулу CaO. Он является белым кристаллическим порошком и активно реагирует с водой, образуя гидроксид кальция. Кальциевый оксид широко используется в производстве цемента, стекла и других конструкционных материалов.
Стронциевый оксид (SrO): Стронциевый оксид имеет формулу SrO. Он является белым кристаллическим порошком и обладает высокой температурной стабильностью. Стронциевый оксид используется в производстве электронных устройств, светодиодов и магнитов.
Бариевый оксид (BaO): Бариевый оксид имеет формулу BaO. Он является белым кристаллическим порошком и обладает высокой температурной стабильностью. Бариевый оксид используется в производстве электронных компонентов, стекла и других промышленных материалов.
Оксиды щелочноземельных металлов являются важными соединениями, используемыми в различных отраслях промышленности и научных исследованиях. Они обладают различными свойствами и широко применяются в производстве различных материалов.
Оксиды неметаллов
Оксиды неметаллов представляют собой соединения кислорода с неметаллическими элементами. Они обладают высокой степенью электроотрицательности и, в отличие от оксидов металлов, часто проявляют кислотные свойства. Оксиды неметаллов образуются в результате соединения неметалла с кислородом при окислении.
Некоторые из наиболее распространенных оксидов неметаллов включают:
- Оксид углерода (СО2) - главный компонент парникового газа и основной отходящий газ, вызывающий эффект парникового газа при сжигании ископаемых топлив.
- Оксид азота (NO2) - главный компонент смога, который наносит вред здоровью, вызывая различные респираторные проблемы.
- Оксид серы (SO2) - важный загрязнитель воздуха, который образуется при сжигании ископаемого топлива и вкладывается в кислотные дожди.
- Оксид фосфора (P2O5) - используется в производстве удобрений и взрывчатых материалов.
Это только несколько примеров оксидов неметаллов, которые играют важную роль в различных отраслях промышленности и окружающей среде.
Знание формул и свойств оксидов неметаллов является основой для понимания их взаимодействия с другими соединениями и их влияния на окружающую среду.
Оксиды благородных газов

Однако, другие благородные газы, такие как криптон (Kr), ксенон (Xe) и радон (Rn), могут образовывать оксиды в экстремальных условиях.
Оксиды благородных газов обычно непстойчивы и трудносгораемы. Они существуют в виде нестабильных соединений, которые разлагаются при нормальных условиях.
Примеры оксидов благородных газов:
- Оксид криптона (KrO3) - нестабильное вещество, разлагается при нагревании.
- Оксид ксенона (XeO3) - также нестабильное соединение, разлагается с выделением кислорода.
- Оксид радона (RnO3) - крайне нестабильное вещество, разлагается с выходом из раствора.
Использование оксидов благородных газов ограничено из-за их нестабильности и небольшого количества таких соединений.








