Направление реакций является одной из основных характеристик химических превращений и играет важную роль в понимании и прогнозировании химических процессов. Оно определяет, в каком направлении протекает химическая реакция, то есть какие вещества участвуют в реакции и какие вещества образуются в результате. Реакции могут протекать в разных направлениях в зависимости от условий, в которых они происходят.
Определение направления реакций является важной задачей для химиков, поскольку позволяет предсказывать результаты реакций и контролировать химические превращения. Например, знание направления реакций позволяет оптимизировать процессы синтеза новых веществ или разложения сложных соединений.
Примеры реакций с обратимым направлением: растворение солей в воде, реакция образования и разложения аммиака, реакция образования и разложения эфиров.
Изучение направления реакций важно также для понимания химического равновесия. Химическое равновесие достигается, когда скорость прямой реакции становится равной скорости обратной реакции. Знание направления реакций позволяет определить условия, при которых равновесие может быть сдвинуто в сторону образования большего количества продукта или, наоборот, в сторону разложения продукта.
В целом, понимание направления реакций играет ключевую роль в химии и помогает исследователям и инженерам разрабатывать новые реакции, улучшать существующие процессы и применять химические превращения в различных областях науки и технологий.
Направление реакций: определение и ее значение в химии

Направление реакций в химии определяет, в какую сторону происходит определенная химическая реакция. Оно указывает на порядок, в котором исходные вещества превращаются в конечные продукты. Направление реакции может быть прямым или обратным.
Прямая реакция движется от реагентов к продуктам. В этом случае, исходные вещества с определенной энергией активации взаимодействуют, образуя новые вещества. Примером прямой реакции является горение, где топливо и кислород соединяются, образуя диоксид углерода и воду.
Обратная реакция происходит от продуктов к реагентам. В этом случае, конечные продукты реакции в определенном равновесии разлагаются обратно на исходные вещества. Обратные реакции нередко влияют на устойчивость равновесия в химических системах.
Знание направления реакций имеет важное значение в химии. Оно помогает понять механизмы химических превращений и прогнозировать результаты реакций. Понимание направления реакций также является основой для разработки новых химических процессов и управления химическими системами.
Что такое направление реакций?
В химии направление реакций означает, в каком направлении происходит химическое превращение вещества. Оно определяет, какие реагенты превращаются в продукты реакции и в каких количествах. Направление реакций может быть прямым, когда реагенты превращаются в продукты, или обратным, когда продукты реакции обратно превращаются в реагенты.
Примером прямой реакции может служить синтез воды из водорода и кислорода:
- 2H2 + O2 → 2H2O
В этом случае водород и кислород реагируют, чтобы образовать воду.
Примером обратной реакции является диссоциация воды на водород и кислород:
- 2H2O → 2H2 + O2
В данном случае вода разлагается на составные элементы водород и кислород.
Направление реакций имеет большое значение для химии, поскольку определяет ход реакции и образование продуктов. Знание направления реакций позволяет прогнозировать результат химических превращений и осуществлять синтез и анализ веществ.
Примеры направленных реакций в химии
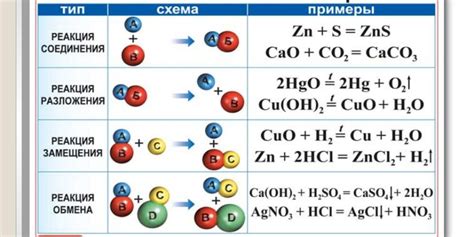
Окисление-восстановление: реакция, в результате которой одно вещество окисляется, а другое восстанавливается. Примером является реакция между кислородом и железом, в результате которой железо окисляется до оксида железа:
- 4Fe + 3O2 → 2Fe2O3
Замещение: реакция, в результате которой одно или несколько атомов или групп замещаются другими. Примером является реакция хлора с натрием, в результате которой хлор замещает натрий:
- 2Na + Cl2 → 2NaCl
Присоединение: реакция, в результате которой молекула присоединяет себе другую молекулу или атом. Примером является реакция между этиленом и галогенами, в результате которой происходит присоединение галогенов к двойной связи этилена:
- C2H4 + Cl2 → C2H4Cl2
- C2H4 + Br2 → C2H4Br2
Это лишь некоторые примеры направленных реакций, которые позволяют химикам контролировать и управлять химическими процессами. Понимание направленных реакций имеет большое значение для различных областей химии, включая органическую, неорганическую и физическую химию.
Важность направленности реакций в химических процессах
Направленность реакций играет ключевую роль во многих химических процессах и имеет важное значение для достижения желаемого продукта. Направленные реакции позволяют контролировать химические превращения и получать конкретные соединения с определенными свойствами.
Одна из главных причин, почему направленность реакций важна, заключается в эффективном использовании ресурсов. В случае, когда реакция происходит без определенного направления, образуются различные продукты, что является нежелательным. Например, в производстве лекарственных препаратов необходимо получать конкретные соединения с определенной структурой. Если реакция не будет направленной, то будет образовано множество нежелательных продуктов, что приведет к потере ресурсов и снижению эффективности производства.
Кроме того, направленность реакций обеспечивает безопасность в химических процессах. В случае, когда реакция не контролируется и не направлена, возможно образование опасных соединений или побочных продуктов, которые могут быть токсичными или взрывоопасными. Управляемая направленность реакций позволяет минимизировать риск возникновения опасных ситуаций и обеспечить безопасность работников и окружающей среды.
Наконец, направленные реакции имеют огромное значение в химическом исследовании и разработке новых соединений. Управляемая направленность реакций позволяет получать новые соединения с определенными свойствами, что является основой для разработки новых материалов, лекарственных препаратов и многих других продуктов. Без контроля направленности реакций, прогресс в этих областях был бы значительно затруднен.
Таким образом, направленность реакций играет важную роль в химических процессах, позволяя контролировать превращения и получать нужные соединения с определенными свойствами. Это обеспечивает эффективное использование ресурсов, безопасность и прогресс в химическом исследовании и разработке новых соединений.
Как определить направленность реакции?

Направленность реакции можно определить на основе состава и энергетических характеристик исходных веществ и продуктов реакции. Существует несколько способов определения направленности реакции:
- Анализ состава реагентов и продуктов. Если в реакции формируются вещества с более устойчивым или более энергетически выгодным составом, то реакция протекает в прямом направлении. Например, в реакции синтеза аммиака из азота и водорода, реагенты имеют более высокую энергию связи, чем продукты.
- Расчет энергетических характеристик реакции. Используя термодинамические данные, можно определить, в каком направлении будет протекать реакция. Например, с помощью значения свободной энергии реакции (ΔG) можно определить, будет ли реакция спонтанной (если ΔG 0).
- Экспериментальные методы. В лабораторных условиях можно провести серию экспериментов, меняя условия реакции (температуру, концентрацию реагентов и т.д.), и наблюдать, в каком направлении меняется содержание реагентов и продуктов. Например, при повышении температуры можно определить, в каком направлении протекает экзотермическая или эндотермическая реакция.
Важно отметить, что направленность реакции имеет большое значение для химии, так как позволяет понять, какие вещества будут образовываться в реакции и как изменится состав системы в процессе химической превращения. Это помогает предсказывать и контролировать химические превращения и является основой для создания новых материалов и разработки новых технологий.








