Уравнения реакций играют ключевую роль в основах химии, поскольку они позволяют описать превращения вещества во время химических реакций. Эти уравнения являются компактной и информативной формой записи химических превращений и помогают ученым в понимании основных принципов и законов химии.
Написание уравнений реакций в химии является процессом, в котором учитываются все взаимодействующие компоненты реагентов и продуктов реакции. Уравнения реакций в химии показывают количество, тип взаимодействия и пропорцию между реагентами и продуктами. Они также помогают определить энергетические изменения, происходящие во время реакции, и позволяют предсказать ее результаты.
Написание уравнений реакций требует использования правил и принципов, которые позволяют соблюдать законы сохранения массы и энергии. Уравнения реакций должны быть сбалансированы, то есть количество атомов каждого элемента должно быть одинаковым на обеих сторонах реакции. Это важно, чтобы сохранить массу вещества, так как во время химической реакции атомы не создаются и не разрушаются.
Написание уравнений реакций в химии является неотъемлемой частью исследований и практики химиков. Они используют уравнения реакций для описания химических превращений, проведения расчетов и предсказания результатов реакций. Понимание и умение писать уравнения реакций помогает в освоении основ химии и является важным инструментом в изучении химических реакций и процессов в природе и промышленности.
Как уравнения реакций в химии помогают описывать процессы

Одной из основных функций уравнений реакций является балансировка. Балансировка уравнений позволяет установить конкретные количественные соотношения между реагентами и продуктами. Это необходимо для определения массы или концентрации веществ, участвующих в реакции. Без балансировки уравнений реакций невозможно провести точный расчет или предсказать результаты реакции.
Уравнения реакций также помогают определить химические свойства веществ. Из уравнения можно получить информацию о структуре молекул, типе химической связи, изменении энергии, образовании новых соединений и др. Знание уравнений реакций позволяет определить, какие вещества обладают реакционной способностью, какие реагенты совместимы между собой и какие продукты образуются в реакции.
Уравнения реакций служат важным инструментом для исследования химических реакций и развития новых технологий. Они позволяют предвидеть и контролировать процессы, происходящие в химических системах, и использовать их в промышленности, медицине, аналитической химии и других областях.
Таким образом, уравнения реакций в химии играют важную роль в описании и понимании процессов, происходящих между веществами. Они позволяют установить конкретные количественные соотношения, определить химические свойства веществ и применить их для различных практических целей.
Важность грамотного оформления химических уравнений
Одной из основных задач в химии является определение стехиометрических соотношений между веществами в реакциях, то есть нахождение соотношения между количеством реагирующих веществ и количеством полученных продуктов. Грамотное оформление химических уравнений позволяет точно определить эти соотношения.
Кроме того, грамотное оформление уравнений позволяет описать сам процесс реакции, то есть указать, какие вещества реагируют между собой, какие продукты образуются, и какие условия (температура, давление и т.д.) необходимы для протекания реакции. Такое оформление уравнений позволяет лучше понять химический процесс и предсказать его результаты.
Грамотное оформление уравнений также позволяет ученым и химикам обмениваться информацией и результатами своих исследований. Стандартизация формата и правил написания химических уравнений позволяет избежать недоразумений и ошибок при передаче информации. Это особенно важно в научной среде, где точность и ясность формулировок играют решающую роль.
В заключение, грамотное оформление химических уравнений является неотъемлемой частью химического анализа и исследования реакций. Оно помогает точно описать реакции, определить стехиометрические соотношения, предсказать результаты реакций и обмениваться информацией в научной среде. Поэтому, важно уделить должное внимание правильному оформлению уравнений, следуя установленным правилам и конвенциям.
Основные правила записи уравнений реакций
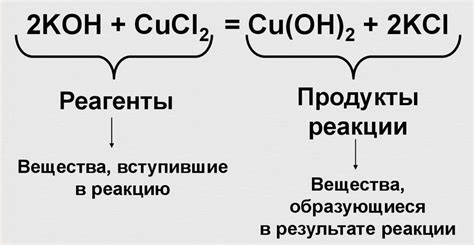
1. Сохранение массы вещества: Уравнение должно быть сбалансировано, то есть справедлив инвариант массы вещества - масса реагентов должна равняться массе продуктов.
2. Сохранение заряда: Уравнение должно быть сбалансировано по зарядам. Это значит, что сумма зарядов веществ на противоположных сторонах реакционного стрелочного уравнения должна быть одинакова.
3. Составление формул: Правильно составленное химическое уравнение должно содержать формулы всех реагентов и продуктов реакции. При этом необходимо учитывать ионы, молекулы и атомы, а также указывать их коэффициенты.
4. Правильное указание фаз: В уравнении реакции необходимо указывать фазы веществ (газ, жидкость, твердое вещество), так как это важно для понимания условий, в которых происходит реакция.
5. Использование правильных знаков: В уравнении реакции следует использовать правильные знаки, такие как стрелка "→" для обозначения превращения реагентов в продукты, а также "+" для показа суммирования реагентов и продуктов.
Правильная запись уравнений реакций в химии позволяет систематизировать и анализировать процессы вещественных превращений, а также предсказывать результаты различных химических реакций.
Принцип сохранения массы в химических реакциях
Это означает, что в начале реакции общая масса реагентов равна общей массе продуктов реакции. Атомы не создаются и не уничтожаются во время химической реакции - они только переупорядочиваются.
При написании уравнений химических реакций, принцип сохранения массы должен быть соблюден. Количество атомов каждого элемента на стороне реактантов должно быть равно количеству атомов этого элемента на стороне продуктов.
Принцип сохранения массы был сформулирован в 18 веке французским химиком Антуаном Лавуазье и является одним из фундаментальных принципов химии.
Пример:
Рассмотрим реакцию горения метана:
CH4 + 2O2 -> CO2 + 2H2O
Масса атомов углерода, водорода и кислорода на стороне реагентов равна массе атомов этих элементов на стороне продуктов, что соблюдает принцип сохранения массы.
Роль химических уравнений в составлении реакционных схем
Составление реакционных схем начинается с формулирования химического уравнения. С помощью химических уравнений можно понять, какие вещества участвуют в реакции, в каких пропорциях и какие продукты образуются.
Химические уравнения демонстрируют закон сохранения массы и энергии, поэтому их использование позволяет строить реакционные схемы, которые описывают последовательность реакций и изменения состояний веществ в химической системе.
Кроме того, химические уравнения предоставляют информацию о термодинамических параметрах реакции, таких как изменение энтальпии, энтропии и свободной энергии. Эти параметры могут быть использованы для расчета эффективности реакции и определения условий, при которых процесс протекает наиболее благоприятно.
Важно отметить, что химические уравнения также играют роль в образовании химических уравнений, называемых реакционными схемами. Реакционные схемы показывают последовательность и взаимосвязь реакций в химической системе, а также представляют информацию о промежуточных веществах и условиях, в которых происходят данные реакции. Реакционные схемы могут быть использованы для анализа химических процессов и определения оптимальных условий для получения желаемых продуктов.
Передача информации о реакционном процессе через уравнения
В уравнениях реакций указываются реагенты, которые участвуют в реакции, а также продукты, которые образуются после реакции. Коэффициенты перед формулами веществ показывают их стехиометрическое соотношение в реакции.
Написание уравнений реакций позволяет провести анализ химической реакции и определить, какие вещества реагируют между собой, какие вещества образуются, а также в каких количествах. Это позволяет предсказывать характеристики и результаты реакции.
Уравнения реакций также позволяют провести вычисления, связанные с химическими превращениями. На основе уравнений можно определить количество веществ, необходимых для проведения определенной реакции. Также с их помощью можно рассчитать количество продуктов реакции и определить степень их переработки.
Важно заметить, что уравнения реакций должны быть сбалансированы - то есть сумма коэффициентов веществ, участвующих в реакции, должна быть одинакова до и после реакции. Это следует из закона сохранения массы - масса всех реагентов должна быть равна массе всех продуктов.
Таким образом, уравнения реакций являются необходимым инструментом в химии для передачи информации о реакционных процессах. Они позволяют анализировать и предсказывать результаты реакций, а также проводить вычисления, связанные с химическими превращениями.
Использование химических уравнений в расчетах

Химические уравнения играют важную роль в расчетах в химии, позволяя определить массу и количество веществ, участвующих в реакции. Используя уравнение реакции, можно вычислить количество реагентов, продуктов, а также узнать, какие массы и объемы соединений необходимы для достижения желаемого результата.
Расчеты с использованием химических уравнений основаны на законе сохранения массы и законе постоянных пропорций. Согласно закону сохранения массы, масса всех реагентов должна быть равна массе всех продуктов реакции. Это позволяет составить уравнение реакции, где коэффициенты перед формулами веществ указывают на количество веществ, участвующих в реакции.
Используя химическое уравнение и известные данные о массе одного или нескольких реагентов, можно вычислить массу других реагентов или продуктов. Для этого необходимо использовать понятие эквивалента, который выражает количество вещества, пропорциональное его молекулярной массе. Например, если известна масса одного реагента в граммах и его молярная масса, можно вычислить количество вещества в молях. Затем, используя соотношение коэффициентов в уравнении реакции, можно определить массу другого реагента или продукта.
Химические уравнения также позволяют провести расчеты с использованием концентрации реагентов и продуктов. Концентрация выражает количество вещества на единицу объема. Используя уравнение реакции и известные концентрации, можно определить концентрацию других веществ или изменение концентрации в процессе реакции.
При проведении расчетов с использованием химических уравнений необходимо учитывать, что реальные реакции могут протекать с различной степенью полноты и сопровождаться побочными реакциями. Также могут возникать трудности с определением точного состава реагентов и продуктов, а также с учетом условий проведения реакции. В этих случаях необходимо использовать данные эксперимента или более сложные методы расчетов.








