В химии существует понятие "электроотрицательность", которое определяет способность атома в молекуле притягивать к себе электроны. Определенные элементы обладают большей электроотрицательностью, чем другие, и такие элементы называются "наиболее электроотрицательными".
Наиболее электроотрицательные элементы, такие как кислород, фтор, хлор и азот, имеют сильное притяжение к электронам. Из-за этого они часто вступают в химические связи с менее электроотрицательными элементами, такими как водород и металлы.
Электроотрицательность наиболее электроотрицательного элемента может сильно влиять на химические связи в молекулах. Когда атом наиболее электроотрицательного элемента связывается с атомом менее электроотрицательного элемента, электроны в большей степени притягиваются к атому наиболее электроотрицательного элемента.
Например, водород и кислород образуют химическую связь в молекуле воды. Кислород является наиболее электроотрицательным элементом в этой молекуле, поэтому он притягивает электроны от водорода, и таким образом создается полярная связь.
Такие полярные связи между наиболее электроотрицательными и менее электроотрицательными элементами образуются не только в молекуле воды, но и в других химических соединениях. Это важно для понимания различных свойств веществ и их химической активности.
Химические связи и электроотрицательность

Электроотрицательность - это способность атома притягивать электроны во время химической реакции. Она характеризует, насколько сильно атом "желает" привлечь электроны к себе. Вещества, содержащие элементы с большой электроотрицательностью, могут образовывать более сильные химические связи.
Наиболее электроотрицательный элемент в периодической системе является фтор (F), у которого электроотрицательность равна 3,98. Фтор обладает очень высокой электроотрицательностью и может образовывать сильные ковалентные связи с другими элементами.
Электроотрицательность влияет на тип химической связи, который образуется между элементами. Вещества, содержащие элементы с большой разницей в электроотрицательности, зачастую образуют ионные связи, где один элемент отдает электроны другому элементу. В то же время, вещества, содержащие элементы с близкой электроотрицательностью, часто образуют ковалентные связи, где электроны общаются и между атомами нет перехода заряда.
Вывод: электроотрицательность элементов играет важную роль в определении типа химической связи и стабильности молекул. Связи, образованные с участием элементов с большим различием в электроотрицательности, обычно являются более крепкими и имеют более высокую энергию связи.
Что такое электроотрицательность?
Электроотрицательность атома может быть измерена на шкале Полинга, которая называется шкалой электроотрицательности. На этой шкале электроотрицательность водорода составляет около 2,1, а электроотрицательность фтора – около 4,0. По шкале Полинга электроотрицательность элементов возрастает с лева направо и снижается сверху вниз в периодической таблице.
Электроотрицательность влияет на образование химических связей. В общем случае, при образовании химической связи между атомами с разной электроотрицательностью, электроны будут тяготеть к атому с большей электроотрицательностью. Это может привести к образованию полярной или ионной связи.
Наиболее электроотрицательный элемент в химии – флуор. Он имеет наивысшую электроотрицательность и, следовательно, способность сильнее притягивать электроны в химических связях. Флуор играет важную роль во многих химических реакциях и соединениях.
Кто является наиболее электроотрицательным элементом?
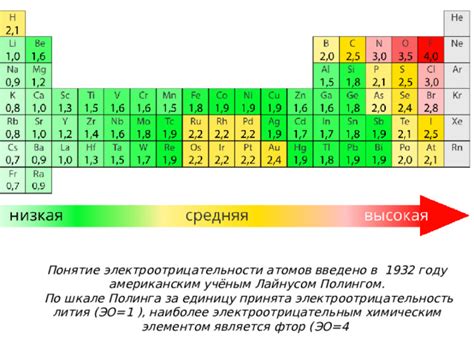
Фтор имеет наиболее высокое значение электроотрицательности среди всех элементов в периодической таблице. Его электроотрицательность составляет 3,98 по шкале Полинга. Это делает фтор самым сильным притягивающим элементом в химии.
Наиболее электроотрицательный элемент, такой как фтор, обычно образует ионические связи с менее электроотрицательными элементами, такими как натрий (Na) или калий (K). Это происходит потому, что фтор "забирает" электроны у этих элементов, образуя отрицательно заряженные ионы.
Кроме того, наиболее электроотрицательный элемент оказывает влияние на полярность химических связей. В молекулах с двойной или тройной связью электроотрицательность элементов определяет, какой из них будет носить частичный положительный заряд, а какой - частичный отрицательный заряд.
Как электроотрицательность влияет на химические связи?
В химических связях с участием двух элементов с разными электроотрицательностями образуется полярная связь. В полярной связи электроны приближаются к более электроотрицательному элементу, создавая разность зарядов между атомами. Это приводит к образованию дипольного момента и возникновению электростатического притяжения между атомами.
Наиболее электроотрицательные элементы в периодической системе находятся в верхнем правом углу, например, флуор, кислород, азот. Они имеют большую электроотрицательность и сильнее притягивают электроны. Наименее электроотрицательные элементы находятся в нижнем левом углу, например, франций, цезий, которые имеют низкую электроотрицательность и слабо притягивают электроны.
Электроотрицательность также влияет на тип химических связей. Если разность электроотрицательностей элементов равна нулю, то связь называется неполярной ковалентной связью. Если разность электроотрицательностей элементов превышает 1,7, то связь называется ионной связью. В остальных случаях образуется полярная ковалентная связь.
Электроотрицательность элементов играет значительную роль в определении свойств веществ. Она влияет на тип связей, степень полярности молекул и их химические реакции. Понимание электроотрицательности элементов помогает прогнозировать химические свойства веществ и понять реакции, которые они могут претерпеть.
Полярные химические связи
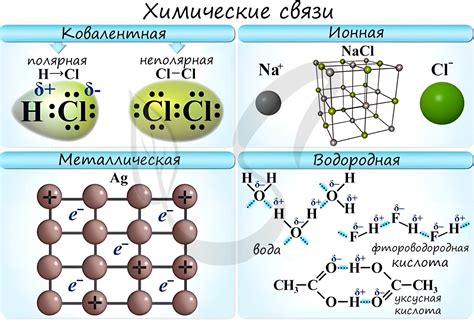
В полярной химической связи электроотрицательный элемент притягивает электроны сильнее, чем менее электроотрицательный элемент. Это создает неравномерное распределение электронной плотности в связи, что делает ее полярной. Таким образом, положительные и отрицательные заряды находятся в разных частях связи, создавая дипольный момент.
Полярные химические связи имеют важное значение в химии. Они играют ключевую роль во многих аспектах химических реакций и взаимодействий. Полярность связей в молекулах влияет на их физические и химические свойства, например, на кипящую точку, плотность, растворимость и т.д. Это также влияет на формирование межмолекулярных взаимодействий, таких как водородные связи, и на свойства соединений в растворах.
Еще одним важным аспектом полярных химических связей является их влияние на реакционную способность молекулы. В реакциях между молекулами с полярными связями, электрофиль обычно атакует место с более высокой электроотрицательностью, в то время как нуклеофиль атакует место с более низкой электроотрицательностью. Это связано с тем, что электрофиль стремится к месту с более высокой электронной плотностью, тогда как нуклеофиль обладает лишними парами электронов и может быть атакующим.
Неполярные химические связи
Неполярные химические связи возникают между атомами, у которых электроотрицательности близки или равны. В таких связях не происходит перераспределения электронов, так как атомы одинаково сильно притягивают электроны к себе.
В результате неполярных связей образуется своеобразный "электронный облак" вокруг атомов, в котором электроны находятся примерно на равном удалении от ядра каждого атома. Такое распределение электронов придаёт молекуле неполярное свойство.
Неполярные связи в основном образуются между атомами одного и того же химического элемента или между атомами элементов, у которых электроотрицательность близка. Примерами элементов, образующих неполярные связи, являются молекулы газов:
- кислород (O2);
- азот (N2);
- водород (H2);
- фтор (F2).
Молекулы с неполярными связями обладают определёнными физическими и химическими свойствами. Например, они малоактивны и не растворимы в полярных растворителях. Кроме того, они обладают низкой температурой кипения и не проводят электрический ток.
Влияние электроотрицательности на поларность молекул

Наиболее электроотрицательные элементы располагаются в правом верхнем углу периодической таблицы Менделеева, такие как кислород, фтор, хлор и азот. Они обладают высокой электроотрицательностью и притягивают электроны сильнее, чем другие элементы в химической связи.
Поларность молекулы зависит от разницы электроотрицательности атомов, входящих в химическую связь. Если атомы различаются в электроотрицательности, возникает полярная связь, где один атом становится частично положительным (+), а другой – частично отрицательным (-).
Полярные молекулы образуют диполи, то есть имеют разделение зарядов внутри молекулы. Этот дипольный момент привлекает соседние молекулы и обуславливает взаимодействие между ними. Таким образом, поларность молекулы влияет на ее свойства, растворимость, температуру кипения и т.д.
Например, вода (H2O) является полярной молекулой из-за разницы в электроотрицательности атомов водорода и кислорода. В результате, молекула воды имеет положительный заряд на водородных атомах и отрицательный на атоме кислорода. Это обуславливает свойства воды, такие как ее высокую теплоту парообразования и способность растворять многие вещества.
В заключение, электроотрицательность влияет на образование поларных молекул и химических связей. Большая разница в электроотрицательности атомов приводит к полярным связям, что в свою очередь определяет поларность молекулы и ее химические свойства.
Электроотрицательность и силы, действующие между атомами
Силы, действующие между атомами, основаны на разнице в электроотрицательности элементов, образующих химическую связь. Если разница в электроотрицательности большая, возникает полярная связь, где один атом становится частично заряженным положительно (меньшая электроотрицательность) и другой атом - частично заряженным отрицательно (большая электроотрицательность). Это приводит к появлению диполя, то есть разделению зарядов.
Силы притяжения между атомами в таких полярных связях называются межмолекулярными взаимодействиями или ван-дер-ваальсовыми силами. Они играют важную роль в образовании и стабильности молекул и межмолекулярных взаимодействиях.
Как выбрать наиболее электроотрицательные элементы для образования ионных связей?
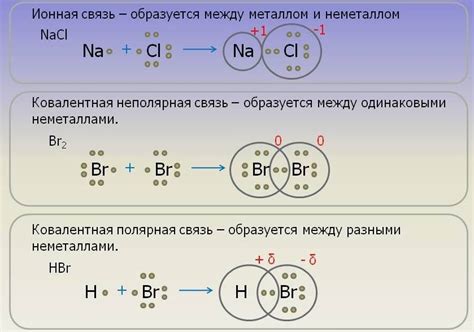
Для образования ионных связей важно выбрать наиболее электроотрицательные элементы. Электроотрицательность элемента определяет его способность притягивать электроны в рамках химической связи. Чем выше электроотрицательность элемента, тем сильнее он притягивает электроны и образует отрицательный ион.
Наиболее электроотрицательные элементы находятся в правом верхнем углу периодической таблицы Менделеева. Это в основном галогены - фтор (F), хлор (Cl), бром (Br), йод (I), и кислород (O). Они обладают высокой электроотрицательностью и легко привлекают электроны, образуя отрицательные ионы.
При выборе элементов для образования ионных связей, нужно обратить внимание на разность их электроотрицательностей. Чем больше разность, тем сильнее будет ионная связь. Например, если выбрать элемент с высокой электроотрицательностью (например, фтор) и элемент с низкой электроотрицательностью (например, натрий), произойдет перенос электронов от натрия к фтору, образуя положительный ион натрия и отрицательный ион фтора.
Если необходимо выбрать элементы для образования катионных ионных связей, лучше использовать элементы с низкой электроотрицательностью. Например, металлы, такие как натрий (Na) или калий (K), могут образовать положительные ионы, привлекая электроны от других элементов с более высокой электроотрицательностью.
Таким образом, для формирования ионных связей необходимо выбрать элементы с высокой и низкой электроотрицательностью. Высокоэлектроотрицательные элементы будут образовывать отрицательные ионы, а низкоэлектроотрицательные - положительные. Это обеспечит образование ионных связей с высокой устойчивостью и энергией связи.
Как выбрать наиболее электроотрицательные элементы для образования ковалентных связей?
Наиболее электроотрицательные элементы имеют большую способность притягивать электроны к себе в химической связи. Это свойство важно при формировании ковалентных связей, так как позволяет определить, какие элементы легко образуют связи с другими и какие необходимо избегать при выборе партнера для связи.
Для выбора наиболее электроотрицательных элементов можно использовать периодическую систему химических элементов. Чем правее и выше находится элемент в таблице, тем он более электроотрицателен.
Некоторые из наиболее электроотрицательных элементов:
- Фтор (F) - самый электроотрицательный элемент в периодической системе. Он образует очень сильные ковалентные связи.
- Кислород (O) - также обладает высокой электроотрицательностью и способен образовывать ковалентные связи с различными элементами.
- Хлор (Cl) - электроотрицательный элемент, который образует стабильные ковалентные связи в соединениях.
- Азот (N) - обладает большой электроотрицательностью и образует ковалентные связи с различными элементами.
Выбор наиболее электроотрицательных элементов для образования ковалентных связей позволяет получить стабильные, прочные и энергетически выгодные соединения. Важно учитывать электроотрицательность элементов при выборе их соединения в химических реакциях и синтезе новых веществ.
Роль электроотрицательности в определении химической активности элементов
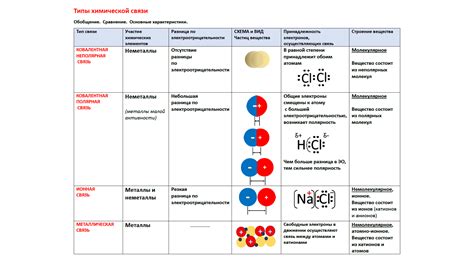
Электроотрицательность - это свойство, которое обычно увеличивается по группе от левой части таблицы Менделеева к правой. Например, электроотрицательность хлора, наиболее электроотрицательного элемента, равна 3,16, в то время как электроотрицательность рубидия, одного из самых электроотрицательных элементов, равна 0,82.
Наиболее электроотрицательные элементы, как правило, формируют ионные связи с менее электроотрицательными элементами. В такой связи, более электроотрицательный элемент получает дополнительные электроны, становясь отрицательно заряженным анионом, а менее электроотрицательный элемент теряет электроны, становясь положительно заряженным катионом.
В молекулах, где все элементы имеют примерно одинаковую электроотрицательность, химическая связь будет называться неполярной ковалентной связью, где общие электроны равномерно распределены между двумя атомами.
Электроотрицательность играет важную роль в химических связях, так как определяет, каким образом атомы элементов будут образовывать связи друг с другом. Более электроотрицательные элементы будут более активными и склонными к образованию связей, в то время как менее электроотрицательные элементы будут менее активными и склонными к получению или потере электронов.
Понимание роли электроотрицательности позволяет объяснить множество явлений в химии и помогает предсказывать свойства различных соединений.








