Молярность раствора – это важная характеристика химического раствора, которая определяется числом молей растворенного вещества, содержащихся в единице объема раствора. Молярность позволяет выразить концентрацию раствора в количественном виде и широко используется в химических расчетах
Для определения молярности раствора необходимо знать массу растворенного вещества и объем раствора. Молярность вычисляется по формуле: молярность (M) = количество вещества (моль) / объем раствора (литры). Данные значения могут быть получены из эксперимента или через математические расчеты на основе известных данных
Например, если в 1 литре раствора содержится 1 моль растворенного вещества, то его молярность составит 1 M. Если в 1 литре раствора содержится 0,5 моль вещества, то молярность составит 0,5 M
Молярность раствора позволяет установить соотношение между количеством растворенного вещества и объемом раствора. Она отражает степень сильного взаимодействия частиц растворенного вещества и растворителя, что влияет на химические свойства раствора и его поведение в реакциях
Понятие молярности раствора

Молярность раствора обозначается символом «М» и может быть определена по следующей формуле:
М = n/V
где М - молярность раствора, n - количество вещества, выраженное в молях, V - объем растворителя, выраженный в литрах.
Молярность раствора позволяет оценить концентрацию растворенного вещества и использовать данную информацию при расчете различных параметров раствора, таких как массовая доля, процентное содержание и др.
| Молярность раствора (М) | Концентрация растворенного вещества |
|---|---|
| 0.1 М | 0.1 моль вещества на 1 литр растворителя |
| 0.5 М | 0.5 моль вещества на 1 литр растворителя |
| 1 М | 1 моль вещества на 1 литр растворителя |
| 2 М | 2 моль вещества на 1 литр растворителя |
Определение и основные характеристики
Молярность раствора является важным показателем его концентрации и позволяет определить количество разведенного или концентрированного раствора. Она зависит от количества растворенного вещества и объема раствора или массы растворителя.
Для определения молярности раствора можно использовать формулу:
Молярность (M) = количество вещества (в молях) / объем раствора (в литрах)
Молярность раствора может быть различной для разных веществ и может изменяться с изменением условий окружающей среды, таких как температура и давление.
Значение для химических реакций
Молярность раствора играет особую роль в реакциях, где важна точная пропорциональность и правильное соотношение между реагентами. Например, при проведении химической реакции, важно знать точную концентрацию раствора для правильного добавления реагента.
Кроме того, молярность раствора позволяет оценить процентное содержание растворенного вещества в растворе и определить его концентрацию. Это может быть полезно при проведении анализов и экспериментов, где требуется знание точной концентрации вещества в растворе.
Способы определения молярности раствора
- Гравиметрический метод: этот метод основан на измерении массы растворенного вещества и объема раствора. После определения массы растворенного вещества, его можно преобразовать в мольную долю, используя молярную массу вещества.
- Количественный анализ: данный метод позволяет определить молярность раствора с помощью различных количественных химических реакций. Например, можно использовать титрование, при котором известный объем раствора добавляется к раствору, в котором молярность определяется, с последующим определением конечного состояния системы.
- Измерение плотности: этот метод основан на измерении плотности раствора. Плотность связана с количеством растворенного вещества в растворе, поэтому ее можно использовать для определения молярности раствора. Зная массу растворенного вещества и объем раствора, можно вычислить молярность.
- Измерение электропроводности: в этом методе измеряется электропроводность раствора. Электропроводность связана с концентрацией растворенных ионов, поэтому ее можно использовать для определения молярности раствора.
Каждый из этих методов имеет свои преимущества и недостатки и может быть применим в различных ситуациях. Выбор метода определения молярности раствора зависит от конкретных требований и условий эксперимента.
Методы экспериментального определения
Существуют несколько методов экспериментального определения молярности раствора:
1. Измерение плотности раствора. Этот метод основан на зависимости плотности раствора от его концентрации. Путем измерения плотности при разных концентрациях можно определить молярность раствора.
2. Реакция с известной концентрацией реактивом. При использовании этого метода известная концентрация реактива добавляется к раствору и происходит химическая реакция. Путем измерения изменений в реакции можно определить молярность исходного раствора.
3. Титрование. Этот метод основан на измерении объема реактивного раствора, необходимого для полного превращения раствора в другое вещество. Путем измерения объема используемого реактива можно вычислить его молярность и, соответственно, молярность исходного раствора.
Расчетная формула молярности раствора
Молярность раствора (М) = количество молей растворенного вещества (n) / объем раствора (V)
где:
- Молярность раствора (М) измеряется в молях на литр (моль/л)
- Количество молей растворенного вещества (n) измеряется в молях (моль)
- Объем раствора (V) измеряется в литрах (л)
Данную формулу можно использовать для рассчета молярности раствора, зная количество молей растворенного вещества и объем раствора. Также можно использовать данную формулу для рассчета количества молей растворенного вещества, зная молярность раствора и объем раствора.
Измерение плотности раствора

Измерение плотности раствора может быть произведено с помощью градуированных пробирок или пикнометра – стеклянной посуды специальной формы с узким горлышком. Процедура измерения состоит из нескольких шагов. Вначале, измеряется масса пробирки пустой, после чего в нее наливают определенный объем исследуемого раствора. Затем масса пробирки с раствором измеряется. Разность масс позволяет вычислить массу растворенного вещества.
Дальнейшие расчеты основываются на полученных данных о массе растворенного вещества и объеме раствора. Молярность раствора может быть определена путем деления массы растворенного вещества на его молярную массу и объем раствора в литрах.
Факторы, влияющие на молярность раствора
Количество растворителя и растворимое вещество: Молярность раствора зависит от количества растворимого вещества, введенного в растворитель. Чем больше вещества растворяется в определенном объеме растворителя, тем выше будет его молярность. Она определяется путем измерения массы растворимого вещества и объема растворителя.
Температура: Температура также оказывает влияние на молярность раствора. Некоторые вещества лучше растворяются при повышенной температуре, в то время как другие - при пониженной. При изменении температуры изменяется степень растворимости вещества и, следовательно, его молярность в растворе.
Давление: Давление оказывает воздействие на молярность раствора только в случае газовых веществ. Увеличение давления на газовый раствор увеличивает его молярность в результате увеличения количества газа, растворенного в определенном объеме растворителя.
Растворимость вещества: Каждое вещество имеет свою уникальную растворимость в различных растворителях. Растворимость вещества, то есть его способность растворяться в растворителе, влияет на его молярность в растворе.
Тип растворителя: Молярность раствора также зависит от выбранного растворителя. Некоторые вещества могут быть лучше растворены в одном растворителе, нежели в другом. Таким образом, тип растворителя влияет на молярность раствора.
Все эти факторы следует учитывать при определении молярности раствора. Они играют важную роль при расчетах и использовании растворов в различных научных и промышленных областях.
Связь между массой и концентрацией раствора
Масса раствора играет важную роль при определении его концентрации. Концентрация раствора может быть выражена различными способами, такими как молярность, массовая доля, объемная доля и др. В данном разделе мы рассмотрим связь между массой раствора и его концентрацией.
Молярность раствора (C) определяется как количество молей растворенного вещества, отнесенное к объему раствора (V):
C = n/V,
где n - количество молей растворенного вещества, V - объем раствора в литрах.
Масса раствора (m) может быть определена с помощью массовой доли растворенного вещества (mр), которая выражается как отношение массы растворенного вещества к массе раствора:
mр = mраств / m.
Масса растворимого вещества (mраств) определяется как масса растворимого вещества, растворенного в единице объема раствора. Таким образом, можно написать:
mраств = C * V * M,
где M - молярная масса растворенного вещества.
Связь между массой раствора (m) и его концентрацией (C) можно записать следующим образом:
m = mраств + mраствителя.
Здесь mраствителя - масса растворителя, а mраств - масса растворенного вещества.
Таким образом, связь между массой и концентрацией раствора выражается через массовые доли растворенного вещества и растворителя, а также через молярность раствора.
Температурные колебания
Температурные колебания могут оказывать существенное влияние на молярность раствора. При повышении температуры молекулярная подвижность увеличивается, что способствует увеличению скорости химических реакций и диффузии в растворе.
Однако в некоторых случаях повышение температуры может вызывать обратный эффект. Например, при растворении газов в жидкости при повышении температуры происходит уменьшение растворимости газа, что приводит к снижению его молярности в растворе.
Также важно отметить, что температурные колебания могут влиять на объем растворителя и растворимость некоторых веществ. Изменение объема растворителя при изменении температуры может привести к изменению концентрации раствора и, следовательно, его молярности.
Температурные колебания являются одним из важных факторов, которые необходимо учитывать при определении молярности раствора и анализе его свойств и влиянии на химические реакции и процессы.
Влияние растворимости вещества
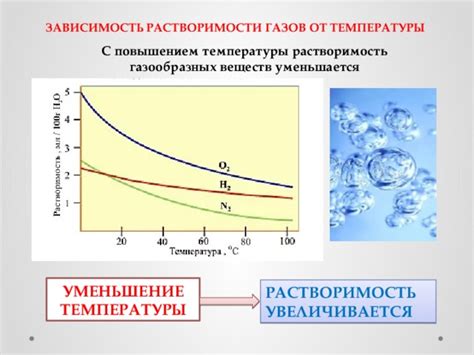
Растворимость вещества является важным понятием в химии, так как влияет на процессы растворения и образования растворов. Знание растворимости может быть полезно при выборе растворителя для проведения определенных химических реакций или при изучении свойств вещества.
Растворимость вещества может быть выражена количественно с помощью понятия молярности раствора. Молярность раствора определяется как количество молей растворенного вещества, содержащегося в 1 литре растворителя. Таким образом, молярность раствора характеризует количественное содержание растворенного вещества в растворе.
Влияние растворимости вещества может проявляться в ряде процессов и явлений. Например, растворимость вещества может определять степень его диссоциации или ассоциации в растворе. Также растворимость может влиять на скорость химической реакции, так как число активных частиц в растворе зависит от их концентрации, которая в свою очередь зависит от растворимости вещества.
Некоторые вещества обладают низкой растворимостью и могут образовывать нерастворимые осадки или кристаллы в определенных условиях. Это может привести к образованию твердых отложений на поверхностях или засорению системы. В то же время, некоторые вещества обладают высокой растворимостью и позволяют получить насыщенные растворы в широком диапазоне концентраций.
Таким образом, растворимость вещества является важным понятием в химии и играет значительную роль в химических реакциях, процессах растворения и формировании растворов.








