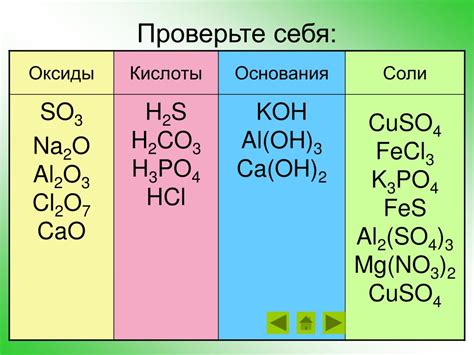
Оксиды — это химические соединения, состоящие из кислорода и другого элемента или группы элементов. В зависимости от их свойств, оксиды могут быть либо кислотными, либо основными, что определяется способностью взаимодействовать с водой.
Кислотные оксиды представляют собой соединения, которые образуют кислоты при растворении в воде. Они проявляются в том, что они реагируют с водой, отдавая протоны и образуя кислоту. Например, оксид серы SO2 при контакте с водой превращается в сульфатную кислоту H2SO4.
К некоторым известным кислотным оксидам относятся оксиды серы, азота, углерода и других элементов. Эти соединения широко используются в промышленности и в повседневной жизни. Например, оксид азота NO2 является причиной образования кислотных дождей и оказывает вредное воздействие на окружающую среду.
Кислотные свойства оксидов имеют важное значение в химии и экологии. Изучение данных свойств позволяет лучше понять процессы, происходящие в природе и в различных промышленных процессах, а также разработать меры по их регулированию и предотвращению отрицательного влияния на окружающую среду.
Физические свойства оксидов

Одно из важнейших физических свойств оксидов - это их состояние при обычных условиях. Некоторые оксиды являются газообразными веществами, например, оксид азота (NO) или оксид углерода (CO). Другие оксиды могут быть жидкими (например, оксид серы (SO2)) или твердыми (например, оксид кальция (CaO) или оксид алюминия (Al2O3)). Это связано с различными структурами и связями в молекулах оксидов.
Кроме состояния, физические свойства оксидов еще включают их плотность, температуру плавления и кипения, теплоемкость и теплопроводность. Например, оксид алюминия имеет высокую температуру плавления (около 2050 градусов Цельсия), что делает его очень прочным и твердым материалом. Оксид углерода, наоборот, имеет низкую температуру плавления и является газообразным при комнатной температуре.
Физические свойства оксидов могут зависеть от структуры и состава молекулы, а также от типа связей между атомами. Например, оксиды металлов обычно обладают высокой электропроводностью, так как их молекулы содержат свободные электроны, которые способны передвигаться веществе и образовывать электрический ток.
Все эти физические свойства делают оксиды важными и полезными веществами не только в химической промышленности, но и в различных других отраслях. Они применяются в строительстве, металлургии, электронике и многих других областях, что подчеркивает их большую значимость.
Определение кислотных свойств
При гидратации оксида, его атомы кислорода принимают два электрона от протона воды (H+) и связываются с водородными ионами, образуя кислоту. Протон воды, в свою очередь, встраивается в кристаллическую решетку оксида. Этот процесс протекает с образованием иона гидроксила (OH-), который оказывает восстановительное действие на вещество оксида, делая его более активным.
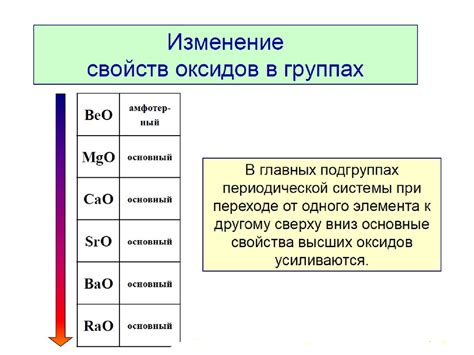
Важно отметить, что кислотные свойства оксидов зависят от их химического состава и степени окисления. Некоторые оксиды, такие как оксид натрия (Na2O) и оксид кальция (CaO), обладают выраженными кислотными свойствами и могут с легкостью растворяться в воде, образуя щелочные растворы. Другие оксиды, такие как оксид железа (Fe2O3) и оксид алюминия (Al2O3), обладают амфотерными свойствами, что означает, что они могут взаимодействовать как с кислотами, так и с щелочами.
Определение кислотных свойств оксидов является важным для их применения в различных областях химии и технологий. Например, кислотность оксидов может быть использована для регулирования pH растворов или для катализа реакций, таких как окисление или гидратация органических соединений.
Механизм проявления кислотных свойств оксидов
1. Оксид взаимодействует с молекулами воды.
2. Молекула воды, в результате взаимодействия с оксидом, теряет один или несколько протонов (H+ и/или OH-) и превращается в кислоту.
3. Протоны, высвободившиеся из молекул воды, присоединяются к оксиду, что приводит к образованию гидроксоксид-ионов (OH-), которые в свою очередь разлагаются, образуя OH- и O2-.
В результате такой реакции образуется кислота и гидроксоксид-ионы, которые могут реагировать с другими веществами и проявлять свои химические свойства.
Примером оксидов с кислотными свойствами являются оксиды неметаллов, такие как оксид серы (SO3) и оксид азота (NO2). Они реагируют с водой, образуя серную и азотную кислоты соответственно.
Важность кислотных свойств оксидов
Одним из примеров оксидов, проявляющих кислотные свойства, являются оксиды неметаллов. Неметаллические оксиды, такие как диоксид углерода (CO2) и диоксид серы (SO2), реагируют с водой, образуя карбоновую и серную кислоты соответственно. Эти оксиды также могут реагировать с основаниями, образуя соли.
Кислотные свойства оксидов часто используются в промышленности и научных исследованиях. Например, в процессе производства удобрений используются оксиды азота (NOx), которые обладают кислотными свойствами и реагируют с аммиаком, образуя азотные кислоты. Эти кислоты выполняют важную роль в стимулировании роста растений.
Кроме того, кислотные свойства оксидов имеют значение в понимании атмосферной химии. Оксиды серы и азота, которые образуются при сжигании топлива, могут растворяться в воде и образовывать кислотные дожди. Это может привести к увеличению кислотности почвы и повреждению растений, а также загрязнению водных ресурсов.
В заключение, кислотные свойства оксидов имеют широкое применение и значимость в различных областях. Они играют важную роль в реакционах и процессах, происходящих в природе, промышленности и научных исследованиях, их изучение позволяет лучше понимать и контролировать химические процессы.
Примеры оксидов с выраженными кислотными свойствами
- Диоксид серы (SO2) - растворяется в воде и образует серную кислоту (H2SO4), которая является одним из самых важных промышленных кислотных соединений.
- Диоксид углерода (CO2) - растворяется в воде и образует угольную кислоту (H2CO3). Это вещество играет важную роль в биохимии и является одним из основных компонентов газового состава атмосферы.
- Оксид азота (NO2) - растворяется в воде и образует азотную кислоту (HNO3). Азотная кислота широко используется в химической промышленности для производства удобрений и взрывчатых веществ.
- Оксид серы (SO3) - реагирует с водой и образует серную кислоту (H2SO4). Этот оксид является одним из основных компонентов промышленных кислотных соединений.
- Оксид фосфора (P2O5) - растворяется в воде и образует фосфорную кислоту (H3PO4). Это вещество является одним из ключевых компонентов удобрений и используется в производстве медицинских препаратов.
Эти примеры оксидов с выраженными кислотными свойствами являются лишь небольшой частью многообразия оксидов, которые могут обладать кислотными свойствами. Оксиды представляют собой важную группу химических соединений, которые играют существенную роль в различных отраслях науки и промышленности.
Применение оксидов с кислотными свойствами
Оксиды с кислотными свойствами широко применяются в различных областях науки и техники. Их уникальные химические свойства позволяют использовать их в разных процессах и производствах.
Одним из основных применений оксидов с кислотными свойствами является их использование в производстве кислот. Такие оксиды служат важным сырьем при производстве разнообразных кислот, включая серную, азотную и фосфорную кислоты. Кислоты, в свою очередь, находят широкое применение в разных отраслях промышленности, включая химическую, фармацевтическую и пищевую.
Другое важное применение оксидов с кислотными свойствами связано с их использованием в производстве электролитов для аккумуляторов. Электролиты, содержащие такие оксиды, обладают высокой электропроводностью и стабильностью. Это позволяет использовать аккумуляторы на основе таких электролитов в различных устройствах, включая мобильные телефоны, ноутбуки и электромобили.
Оксиды с кислотными свойствами также находят применение в производстве катализаторов. Катализаторы на основе таких оксидов активно используются в химической промышленности для ускорения химических реакций и повышения эффективности процессов. Благодаря своим кислотным свойствам, такие оксиды способны взаимодействовать с молекулами реагентов и облегчить протекание реакции.
| Применение | Описание |
|---|---|
| Производство кислот | Оксиды с кислотными свойствами используются в производстве различных кислот, таких как серная, азотная и фосфорная кислоты. |
| Производство электролитов | Такие оксиды применяются при производстве электролитов для аккумуляторов, обладающих высокой электропроводностью и стабильностью. |
| Производство катализаторов | Оксиды с кислотными свойствами используются в производстве катализаторов для ускорения химических реакций и повышения эффективности процессов. |
Таким образом, оксиды с кислотными свойствами играют важную роль в различных областях науки и промышленности, благодаря своим уникальным химическим свойствам.
Взаимодействие оксидов с другими веществами

Оксиды, как и любые другие химические соединения, могут взаимодействовать с другими веществами, образуя новые соединения. Взаимодействие оксидов с другими веществами может быть кислотным, щелочным или нейтральным, в зависимости от их химических свойств и среды, в которой происходит реакция.
Кислотные оксиды могут реагировать с водой, образуя кислоты. При этом образующаяся кислота может быть как минеральной, так и органической. Например, при взаимодействии оксида серы (SO2) с водой образуется сульфитная кислота (H2SO3).
Взаимодействие основных оксидов с водой приводит к образованию щелочей. Например, оксид кальция (CaO) реагирует с водой, образуя гидроксид кальция (Ca(OH)2), который является щелочью.
Некоторые оксиды могут проявлять амфотерные свойства, то есть они могут реагировать как с кислотами, так и с щелочами, образуя соли. Например, оксид алюминия (Al2O3) образует алюминия гидроксид (Al(OH)3) как при реакции с водой (образуется щелочь), так и при реакции с кислотой (образуется соль).
Взаимодействие оксидов с другими веществами играет важную роль в химических реакциях и имеет большое значение в промышленности и в повседневной жизни.
Кислотные свойства оксидов в природе и в промышленности
В природе многие оксиды проявляют кислотные свойства, что означает, что они реагируют с водой, образуя кислоты. Например, оксид углерода, известный как угарный газ (CO2), растворяется в воде и образует угольную кислоту (H2CO3). Также азотные оксиды (NOx) взаимодействуют с водой и образуют азотную кислоту (HNO3).
Кислотные свойства оксидов имеют практическое применение в промышленности. Например, сернистый оксид (SO2) можно использовать для производства серной кислоты (H2SO4), которая широко применяется в производстве удобрений, жидкого мыла и других химических продуктов.
Кроме того, оксиды металлов, такие как оксид алюминия (Al2O3) и оксид железа (Fe2O3), имеют кислотные свойства и используются для получения соответствующих кислот. Например, оксид алюминия применяется для производства алюминиевой кислоты (Al(OH)3) и алюминиясодержащих лекарственных препаратов.
Таким образом, кислотные свойства оксидов играют важную роль как в природе, так и в промышленности. Они позволяют получать различные кислоты и применяются в производстве разнообразных химических веществ и продуктов.








