Кислая среда – это среда, в которой концентрация ионов водорода (H+) превышает концентрацию ионов гидроксида (OH-). Кислоты – это химические соединения, которые могут отдавать протоны (ионы водорода) другим веществам или растворяться в воде с образованием ионов водорода. Например, серная кислота (H2SO4) и уксусная кислота (CH3COOH) являются кислотами.
Когда раствор находится в кислой среде, ионы водорода вступают в реакцию с другими веществами, изменяя их свойства и активность. Кислая среда влияет на скорость химических реакций, а также на их направленность и равновесие. Кислые растворы могут протекать более быстро или медленнее, чем нейтральные или щелочные растворы, в зависимости от конкретных условий и реагентов.
Для кислых растворов характерна также способность образовывать источники электролитов. Ионизация кислот приводит к увеличению концентрации ионов в растворе.
Кислая среда имеет огромное значение во многих областях науки и технологии. Например, в биологии она влияет на работу ферментативных систем и физиологические процессы в организмах. В промышленности кислые растворы применяются для очистки и обезжиривания поверхностей, синтеза органических соединений, а также в процессах окисления и дегидрирования.
Что такое кислая среда раствора
Кислоты - это соединения, которые способны отдавать положительные ионы водорода в раствор, тем самым повышая его концентрацию. Часто кислоты имеют коррозивные свойства и могут вызывать ощущение жжения при контакте с кожей или слизистыми. Примерами кислот могут служить уксусная кислота, серная кислота и соляная кислота.
Кислая среда раствора играет важную роль в химических реакциях. Она может влиять на скорость химических реакций, а также на структуру и свойства самих веществ. Многие реакции происходят только в кислой среде, и изменение pH может привести к изменению направления и скорости этих реакций.
В кислой среде раствора могут происходить реакции окисления-восстановления, диссоциации, гидратации и многие другие. Благодаря кислой среде можно проводить такие важные процессы, как электролиз воды, протекание гальванических элементов, а также использование кислот в медицине и промышленности.
Определение и свойства
Когда раствор имеет кислую среду, он обладает определенными свойствами. Вот некоторые из них:
- Кислоты при взаимодействии с водой образуют ионы водорода (H+), которые работают как подставки в химических реакциях.
- Кислоты могут реагировать с основаниями, образуя соль и воду.
- Кислотные растворы обладают кислым вкусом и могут вызывать жжение и раздражение на коже.
- Кислотные растворы обычно имеют низкую вязкость и хорошо растворяются в воде.
- Кислоты могут иметь различные степени кислотности, выраженные на шкале pH.
Кислая среда раствора играет важную роль в химических реакциях. Она может ускорять или замедлять скорость химических реакций, а также влиять на их направленность и продукты.
Формирование кислой среды
Кислоты играют важную роль в формировании кислой среды раствора. Они могут быть представлены различными веществами, включая органические и неорганические кислоты.
Органические кислоты, такие как уксусная кислота и лимонная кислота, образуются в организмах животных и растений. Они также могут быть синтезированы в лабораторных условиях. Эти кислоты проявляют кислотные свойства, когда они растворяются в воде.
Неорганические кислоты образуются при реакциях между различными химическими веществами. Некоторые из них включают серную кислоту, соляную кислоту и соляную кислоту. Эти кислоты также имеют кислотные свойства при растворении в воде.
Формирование кислой среды раствора может происходить, когда кислоты растворяются в воде и образуют ионизированные частицы, называемые ионами водорода (H+). Большее количество ионов водорода делает раствор более кислотным.
Кислая среда имеет влияние на химические реакции. Кислотные растворы могут изменять скорость реакций, а также способствовать происхождению новых реакций. Они также могут оказывать влияние на реакции растворения и осаждения, изменяя растворимость веществ.
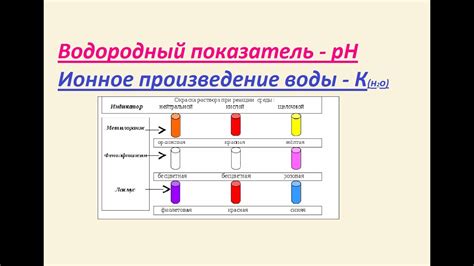
Определение pH
В химии используется понятие pH (потенциал водорода) для определения кислотности или щелочности раствора. pH меряется на шкале от 0 до 14.
Значение pH 7 соответствует нейтральному раствору, когда концентрация ионов водорода (H+) и гидроксидных ионов (OH-) равны. Раствор с pH менее 7 считается кислым, а с pH больше 7 – щелочным.
Математическая формула для расчета pH:
pH = -log[H+], где [H+] – концентрация ионов водорода в растворе.
На практике pH можно измерить с помощью pH-метра, который показывает точное значение на индикаторе. Также существуют специальные красители и бумажные полоски-индикаторы, которые меняют свой цвет в зависимости от pH раствора.
Влияние кислой среды на химические реакции

Кислотность среды изменяет концентрацию ионов веществ, как реагентов, так и продуктов реакций. Это может привести к изменению скорости реакций, выбору побочных продуктов, а также изменению равновесия химической реакции.
Повышение концентрации ионов водорода (H+) может увеличить скорость реакции. Это объясняется тем, что наличие большего количества ионов водорода обеспечивает большее число столкновений между молекулами реагентов, что способствует увеличению вероятности их активации и образования новых химических связей.
Кроме того, кислотность среды может изменить выбор побочных продуктов реакции. Наличие большего количества ионов водорода может активировать различные пути реакции, что приводит к образованию разных продуктов. Это может быть полезным при синтезе определенных химических соединений.
Изменение концентрации ионов водорода влияет также на равновесие химической реакции. Увеличение концентрации ионов H+ может привести к смещению равновесия реакции в сторону образования продуктов или реагентов, в зависимости от условий реакции.
Таким образом, кислая среда играет важную роль в протекании химических реакций, влияя на их скорость, выбор побочных продуктов и равновесие. Это позволяет управлять процессами синтеза и превращения веществ, а также применять кислотность в различных химических процессах и технологиях.
Реакции окисления и восстановления
В кислой среде происходят следующие реакции:
- Окисление воды: 2H2O → O2 + 4H+ + 4e-
- Восстановление воды: O2 + 4H+ + 4e- → 2H2O
- Окисление молекулы водорода: H2 → 2H+ + 2e-
- Восстановление молекулы водорода: 2H+ + 2e- → H2
Во всех этих реакциях, происходящих в кислой среде, электроны передаются от одного вещества к другому. Эти реакции широко используются в различных процессах, таких как электролиз и гальванические элементы.
Взаимодействие с металлами
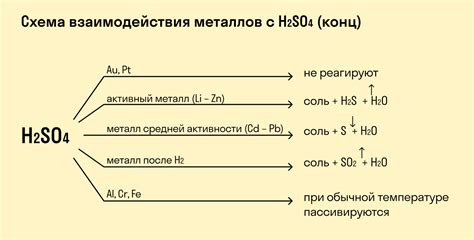
Кислая среда раствора существенно влияет на взаимодействие металлов с другими веществами. При наличии кислотных ионов в растворе происходит окислительно-восстановительные реакции, которые могут привести к различного рода химическим изменениям металлических поверхностей.
Когда металл погружается в кислый раствор, образуется электролитическая ячейка, в которой металл является одним из электродов. Происходит взаимодействие металла с ионами водорода или гидроксония, что может привести к выделению газов или образованию новых соединений.
Некоторые металлы, такие как железо и алюминий, при контакте с кислотой покрываются защитной пленкой оксида, которая предотвращает их дальнейшую коррозию. Однако другие металлы, такие как цинк и свинец, могут растворяться в кислоте, образуя растворимые соли и выделяя газы.
Таким образом, кислая среда раствора может быть как защитной для некоторых металлов, так и вызывать их разрушение или изменение поверхности. Взаимодействие металлов с кислотным раствором имеет широкое применение в промышленности и научных исследованиях.








