Газ — одно из трех основных состояний вещества, обладающее свойством занимать форму и объем контейнера, в котором он находится. При нормальных условиях газ представляет собой смесь невидимых газообразных частиц, таких как атомы, молекулы или ионы. Этот состояние вещества находится между жидкостью и плазмой, обладая свойствами обоих состояний.
Газы обладают несколькими основными свойствами, которые определяют их поведение и применение в различных областях науки и техники. Во-первых, газы расширяются или сжимаются в зависимости от изменения давления и температуры. Это свойство объясняет их способность занимать весь объем доступного пространства. Во-вторых, газы имеют низкую плотность по сравнению с жидкостями и твердыми телами, что делает их легкими и подвижными. В-третьих, газы обладают высокой подвижностью, способностью распространяться в виде волн или частиц.
Интересно, что газы обладают также способностью смешиваться без видимых изменений и сохранять гомогенное состояние. Благодаря этому свойству, они легко и равномерно распределяются на большие расстояния и заполняют все имеющиеся пространства.
Газы играют важную роль в различных сферах человеческой деятельности. Они используются в производстве и промышленности, энергетике и транспорте. Также газы используются в научных и медицинских исследованиях, а также в быту и повседневной жизни. Понимание и изучение свойств газов при нормальных условиях необходимо для эффективного использования и контроля этого вида вещества.
Определение газа при нормальных условиях
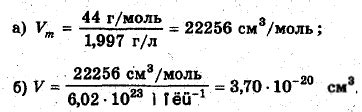
Газ как физическое состояние вещества
Основные свойства газа при нормальных условиях включают его сжимаемость, расширяемость, низкую плотность и высокую подвижность. Газы обладают высокой подвижностью, так как их молекулы имеют большую кинетическую энергию и проявляют беспорядочное тепловое движение.
Газы расширяются при нагревании и сжимаются при охлаждении. Это связано со свойством газовых молекул перемещаться в пространстве и занимать объем, доступный им. При повышении температуры газовые молекулы увеличивают свою скорость и занимают больший объем, а при понижении температуры они замедляются и занимают меньший объем.
Газы обладают низкой плотностью по сравнению с твердыми и жидкими веществами. Из-за большого расстояния между молекулами и их высокой подвижности газы имеют небольшую массу и объем. Это также позволяет газам заполнять любое имеющееся пространство и равномерно распределяться в нем.
Газы являются хорошими электрическими и тепловыми проводниками. Это происходит из-за наличия свободно движущихся зарядов или частиц, которые могут эффективно переносить тепловую и электрическую энергию.
Свойства газа при нормальных условиях

| Свойство | Описание |
|---|---|
| Разрежимость | Газы обладают высокой степенью разрежимости, то есть их молекулы находятся на большом расстоянии друг от друга. Именно поэтому газы легко сжимаются и расширяются под воздействием давления. |
| Молекулярная подвижность | Молекулы газов постоянно находятся в движении, сталкиваясь друг с другом и со стенками сосуда. Это обусловливает давление газа и его способность распространяться. |
| Расширяемость | Газы, под действием повышенной температуры, расширяются и занимают больший объем. Это вызвано увеличением средней кинетической энергии молекул газа. |
| Прозрачность | Большинство газов прозрачны для видимого света и других форм электромагнитного излучения. Это объясняется тем, что молекулы газа имеют малые размеры по сравнению с длиной волны видимого света. |
| Свободное перемешивание | Газы могут свободно перемешиваться друг с другом, если они находятся в одном сосуде. Это связано с высокой подвижностью молекул газа и их случайными столкновениями. |
| Низкая плотность | Газы обладают низкой плотностью, так как их молекулы находятся на большом расстоянии друг от друга. Это приводит к тому, что газы имеют малую массу в отношении объема. |
| Сжимаемость | Газы легко поддаются сжатию под действием внешнего давления. Это связано с большими интермолекулярными расстояниями в газе и большими промежутками между молекулами. |
Сжимаемость вещества в газообразном состоянии
Сжимаемость газа обусловлена тем, что в газообразном состоянии между молекулами существует большое расстояние, по сравнению с размерами самих молекул. Поэтому, когда на газ действует внешнее сжимающее воздействие, молекулы газа сближаются друг с другом, уменьшая объем. Это приводит к увеличению плотности газа.
Коэффициент сжимаемости - это величина, характеризующая степень сжимаемости газа. Он определяется как отношение изменения давления к изменению объема газа. Чем больше значение коэффициента сжимаемости, тем легче сжимать газ. Если газ является идеальным газом, то его коэффициент сжимаемости равен нулю, так как идеальный газ считается несжимаемым.
Сжимаемость газа также зависит от температуры и давления. При повышении давления или понижении температуры газ становится более сжимаемым. Это связано с изменением межмолекулярных сил и теплового движения молекул газа.
Сжимаемость газа является важной характеристикой при решении различных задач, связанных с использованием газов. Например, при хранении и транспортировке газа необходимо учитывать его сжимаемость для правильного расчета объема и условий хранения.
Особенности газа при нормальных условиях

1. Разреженность: Газ состоит из молекул, которые находятся на значительном расстоянии друг от друга. Из-за этого газ обладает низкой плотностью и может легко сжиматься и расширяться под воздействием давления.
2. Высокая подвижность: Молекулы газа постоянно движутся в хаотичном порядке и имеют большую скорость. Из-за этого газ обладает высокой подвижностью и может быстро заполнять любое доступное пространство.
3. Неимеет форму и объем: Газ не имеет определенной формы и объема. Он полностью занимает любой контейнер, в котором находится, и принимает его форму. При изменении условий давления и температуры газ может легко изменять свой объем и форму.
4. Прозрачность: Газы обладают прозрачностью, что означает, что они не поглощают свет на видимом диапазоне. Это делает газ невидимым для человеческого глаза.
5. Универсальность: Газы являются универсальным состоянием вещества, так как многие вещества могут существовать в газообразном состоянии при нормальных условиях. Например, кислород, азот и водород представляют собой примеры веществ, которые могут существовать в газообразной форме при нормальных условиях.
6. Газы обладают низкой плотностью, низкой вязкостью и низкой теплопроводностью. Они обладают высокой компрессибильностью, то есть способностью сжиматься и расширяться под воздействием давления и температуры. Такие особенности делают газы важными для использования в различных областях науки и техники, включая промышленности, медицине и энергетике.
Высокая подвижность молекул газа
Подвижность молекул газа позволяет им заполнять доступное пространство равномерно, распространяясь во всех направлениях. Газы могут заполнять любые объемы, не обладая фиксированной формой или объемом, в отличие от твердых тел и жидкостей.
Движение молекул газа может быть описано с помощью кинетической теории газов. Согласно этой теории, молекулы газа представляют собой частицы с массой, имеющие тепловую энергию и сталкивающиеся друг с другом и со стенками сосуда. Эти столкновения создают давление газа.
Высокая подвижность молекул газа имеет ряд практических применений. Например, она позволяет газу легко распространяться и смешиваться с другими газами, что обеспечивает эффективность многих химических реакций. Кроме того, подвижность газа обеспечивает его диффузию через полупроницаемые мембраны, что может быть использовано, например, при разделении газовых смесей или очистке воздуха.








