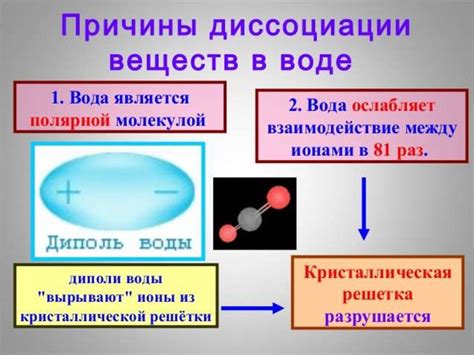
В химии существует процесс, называемый электролитической диссоциацией. Это явление, когда вещество, находящееся в растворе, расслаивается на ионы под воздействием электрического тока. Такая диссоциация происходит поэтапно, поэтому часто говорят о том, что электролитическая диссоциация проходит ступенчато.
Ионы, образованные в результате электролитической диссоциации, обладают электрическим зарядом и могут перемещаться под воздействием электрического поля. Это позволяет проводить электрический ток через раствор электролита. Именно эта особенность и делает электролитическую диссоциацию так важной для химии и различных процессов, связанных с проведением электрического тока в растворах.
Понимание принципов электролитической диссоциации особенно важно в химическом анализе и синтезе, а также в решении различных практических задач, связанных с электролитами. Знание о процессе ступенчатой диссоциации поможет в подготовке электролитов для различных электрохимических процессов и позволит избегать ошибок в химических экспериментах.
Электролитическая диссоциация: рассмотрим её сущность
Процесс электролитической диссоциации проходит ступенчато, то есть электролит расщепляется на ионы на молекулярном уровне. Это означает, что каждая молекула электролита может диссоциировать на определенное количество ионов. Например, хлорид натрия (NaCl) при диссоциации образует ионы натрия (Na+) и ионы хлора (Cl-). Это происходит по следующей реакции:
- NaCl → Na+ + Cl-
Таким образом, электролитическая диссоциация играет ключевую роль в понимании поведения электролитов в растворах. Она объясняет, почему некоторые вещества могут проводить электрический ток, в то время как другие неспособны к этому. Также электролитическая диссоциация помогает понять различные физические и химические свойства растворов электролитов.
Электролитическая диссоциация: определение и принцип действия
Принцип действия электролитической диссоциации основан на взаимодействии молекул вещества с молекулами растворителя. При этом, растворителем могут быть как вода, так и другие жидкости. Под воздействием растворителя, между молекулами происходит размягчение связей, что позволяет ионам выходить из молекулы вещества и образовывать новые связи с молекулами растворителя.
Результатом электролитической диссоциации является образование диссоциированных ионов, которые образуют ионный раствор. Диссоциированные ионы изначального вещества становятся свободно подвижными и приобретают способность проводить электрический ток. Они могут представлять собой как положительно, так и отрицательно заряженные ионы.
Электролитическая диссоциация важна для понимания реакций и свойств многих веществ. Она объясняет, почему некоторые растворы обладают электропроводностью, а другие - нет. Также, электролитическая диссоциация играет значительную роль в многих процессах, таких как электролиз, солеобразование и др.
| Примеры типов электролитов: |
|
Примеры электролитической диссоциации в природе
Один из ярких примеров электролитической диссоциации в природе – морская вода. Морская вода содержит различные растворенные соли, такие как натрий, хлор, кальций, магний и другие. Под действием электрического поля эти соли разделяются на положительно и отрицательно заряженные ионы, что делает морскую воду электролитом.
Ещё одним примером является раствор аммиака в воде. При диссоциации аммиака, т.е. его разделении на ионы, образуются ионы аммония NH4+ и гидроксидные ионы OH-. Это обуславливает щелочные свойства раствора аммиака.
Также стоит отметить растворы кислот, таких как соляная кислота или уксусная кислота. Под действием электрического поля эти кислоты распадаются на положительно заряженные ионы водорода H+ и отрицательно заряженные остатки.
В природе можно наблюдать множество других примеров электролитической диссоциации, которые помогают нам понять, как происходит разделение веществ на ионы под влиянием электрического поля.
Электролитическая диссоциация: основные принципы
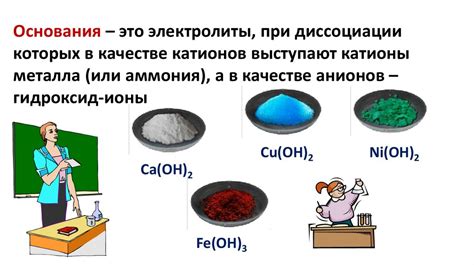
- Электролиты - это соединения, способные диссоциировать в растворе на ионы. Такие вещества обладают высокой проводимостью и являются электролитами. Примерами электролитов являются соли, кислоты и щелочи.
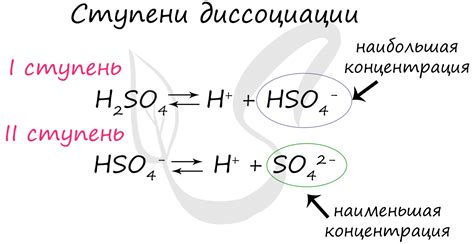
- Ступенчатая диссоциация происходит при пошаговом разделении ионного соединения на ионы различных зарядов. Вначале происходит разделение на ионы первого рода, затем на ионы второго рода и так далее. Каждый шаг диссоциации сопровождается образованием новых ионов.
- Степень диссоциации - это отношение числа диссоциировавших молекул к общему числу молекул ионного соединения. Степень диссоциации показывает, насколько полная или неполная диссоциация произошла в растворе. Обычно степень диссоциации выражается в процентах.
- Обратная диссоциация - это процесс обратного объединения ионов в родительское ионное соединение. Обратная диссоциация может происходить при изменении условий раствора, например, при изменении температуры или концентрации раствора.
Понимание основных принципов электролитической диссоциации позволяет объяснить множество химических реакций и явлений, а также применять эти знания в практических целях, например, при проведении электролиза или изготовлении электролитических растворов.
Роль электролитической диссоциации в химических реакциях
Электролитическая диссоциация играет важную роль во многих химических реакциях. Этот процесс происходит, когда молекулы электропроводящего вещества распадаются на ионы под влиянием электрического тока.
Разложение происходит в растворах, где молекулы электролита погружены в растворитель. В зависимости от своей природы, электролиты могут быть полностью или частично диссоциированы.
В полностью диссоциированных электролитах, практически все молекулы распадаются на ионы, такие как катионы и анионы. Примерами таких электролитов являются сильные кислоты и щелочи.
Частичная диссоциация происходит в случае слабых электролитов, где только небольшая часть молекул распадается на ионы. Примером слабого электролита может служить уксусная кислота.
Реакции, в которых участвуют ионы, обладают уникальными свойствами. Ионы могут действовать как катализаторы или участвовать в образовании осадков при соединении с другими ионами восстановления или окисления.
Также электролитическая диссоциация играет важную роль в электролизе, где электрический ток используется для разложения вещества на ионы.
В заключение, электролитическая диссоциация является ключевым процессом во многих химических реакциях. Понимание этого процесса помогает объяснить поведение электролитов в реакциях и определить их роль в образовании новых соединений.
Диссоциация электролитов: проходит ли все ступенчато?
В идеальном случае диссоциация происходит ступенчато, то есть каждая молекула электролита разделяется на два иона. Например, при диссоциации солей натрия и хлорида каждая молекула расщепляется на один ион натрия (Na+) и один ион хлорида (Cl-).
Однако в реальности не все электролиты диссоциируют ступенчато. Некоторые электролиты диссоциируют частично, то есть только часть молекул разделяется на ионы, а другая часть остается в молекулярной форме. Примером такого явления может служить диссоциация некоторых кислот и оснований.
Также стоит учесть, что ступенчатость диссоциации может зависеть от условий, в которых происходит реакция. Температура, концентрация, растворитель – все это может влиять на процесс диссоциации электролитов.
В результате диссоциации электролитов образуются ионы, которые могут быть вовлечены в различные химические реакции и взаимодействия. Это является основой многих процессов, происходящих в растворах и в живых организмах.








