Валентность по водороду – это важное понятие в химии, которое определяет количество атомов водорода, с которыми может соединиться данное вещество. Установление валентности по водороду позволяет более точно описывать химические соединения и их свойства.
В основе определения валентности по водороду лежит идея обмена электронами между атомами. Каждый атом имеет определенное количество электронов в своей внешней оболочке, и в процессе химической реакции они могут передаваться от одного атома к другому. Валентность по водороду показывает, сколько электронов может принять или отдать атом водорода при образовании химической связи.
Примеры веществ с различной валентностью по водороду включают воду (H2O), метан (CH4) и аммиак (NH3). Вода имеет валентность 2, так как каждый атом кислорода в воде связан с двумя атомами водорода. Метан имеет валентность 4, так как каждый атом углерода связан с четырьмя атомами водорода. Аммиак имеет валентность 3, так как каждый атом азота связан с тремя атомами водорода.
Знание валентности по водороду является важным при изучении реакций, протекающих в органических и неорганических соединениях. Оно помогает установить количество и тип валентных и невалентных связей, определить химический состав соединений, и предсказать их реакционную активность и структуру.
Таким образом, валентность по водороду играет ключевую роль в химических исследованиях и научных расчетах. Она позволяет точнее определить свойства химических соединений, что в свою очередь способствует развитию новых материалов и технологий в самых разных сферах – от медицины и экологии до энергетики и производства.
Что такое валентность?
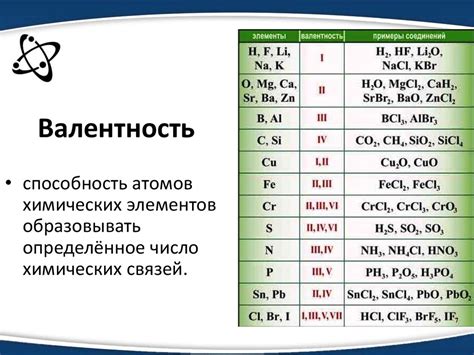
Валентность обычно выражается числом или символом, который указывается после химического символа элемента. Например, валентность кислорода равна -2, что означает, что он имеет способность принять два электрона от других атомов или ионов. Валентность водорода равна +1, поскольку он имеет способность отдать один электрон.
Знание валентности элементов особенно важно при определении состава и формировании химических соединений. Например, для образования воды (H2O) валентность водорода равна +1, а валентность кислорода равна -2. Это означает, что для образования стабильного соединения, два атома водорода должны соединиться с одним атомом кислорода.
Валентность также может меняться в зависимости от условий и типа химической реакции. Изменение валентности элементов может привести к образованию различных соединений и обеспечить разнообразие химических реакций в природе.
Роль водорода в определении валентности
Водород играет важную роль в определении валентности элементов. Валентность водорода равна 1, так как он образует только одну связь с другими атомами. Это позволяет использовать водород как точку отсчета при определении валентности других элементов.
Когда водород соединяется с элементом, валентность последнего определяется разностью между его валентностью и валентностью водорода. Например, если валентность водорода равна 1, а валентность элемента равна 3, то он будет иметь около себя три атома водорода, чтобы достичь полного валентного состояния.
Валентность водорода также позволяет определить степень окисления элементов в соединениях. Степень окисления - это число, которое показывает, сколько электронов перешло с одного атома на другой. Если водород образует соединение с элементом, то степень окисления этого элемента будет равна разности между его валентностью и валентностью водорода.
Например, если валентность водорода равна 1, а степень окисления элемента равна 2, это означает, что за счет атома водорода элемент получил два электрона и имеет положительную степень окисления.
Роль водорода в определении валентности и степени окисления элементов позволяет установить основные принципы химической связи и структуры соединений. Понимание этих принципов играет важную роль в изучении химии и его приложении в различных областях науки и технологии.
Основные принципы
Основными принципами определения валентности по водороду являются:
1. Принцип минимального расхождения.
Согласно этому принципу атом выбирает такую валентность, которая минимизирует разность между полученным зарядом и значением заряда валентного электрона.
2. Принцип электроотрицательности.
Атомы стремятся образовывать соединения с атомами, обладающими различной электроотрицательностью. Этот принцип объясняет, почему атомы с большей электроотрицательностью обычно имеют более высокую валентность.
3. Принцип заполнения энергетических уровней.
Атомы стремятся заполнить свои энергетические уровни путем образования соединений. Этот принцип объясняет, почему атомы обычно имеют валентность, соответствующую необходимому количеству электронов для заполнения их последнего энергетического уровня.
Рассмотрим примеры применения этих принципов для определения валентности по водороду у различных атомов.
[Примеры приводятся в следующем разделе.]
Зависимость валентности от других элементов
Валентность водорода может зависеть от других элементов, с которыми он вступает в химическую реакцию. Валентность водорода в соединениях часто определяется по электроотрицательности другого элемента.
Если водород соединяется с более электроотрицательным элементом, например, кислородом (электроотрицательность кислорода - 3,44), то валентность водорода будет равна +1. Примером такого соединения является вода (H2O), где каждый атом водорода имеет валентность +1, а атом кислорода - валентность -2.
Однако если водород соединяется с менее электроотрицательным элементом, например, металлом, то его валентность будет равна -1. Например, водород может соединяться с металлическим натрием (Na), образуя соединение NaH, где каждый атом натрия имеет валентность +1, а атом водорода - валентность -1.
Таким образом, валентность водорода в соединениях может изменяться в зависимости от электроотрицательности других элементов и типа соединения.
Влияние валентности на структуру вещества

Валентность вещества может быть положительной, отрицательной или нейтральной. Положительная валентность означает, что вещество имеет свободные электроны и способно принимать электроны от других веществ. Отрицательная валентность указывает на наличие свободных электронных пар и способность отдавать электроны другим веществам. Нейтральная валентность означает, что вещество не имеет свободных электронов или электронных пар и не вступает в химическое взаимодействие с другими веществами.
Валентность по водороду имеет большое значение для определения структуры органических соединений. Вода является примером вещества с нейтральной валентностью по водороду, так как она не образует свободных электронов или электронных пар. Это объясняет ее наименьшую химическую активность среди соединений.
| Валентность | Примеры |
|---|---|
| Положительная | Натрий (Na), калий (K) |
| Отрицательная | Кислород (O), сера (S) |
| Нейтральная | Вода (H2O), метан (CH4) |
Важно отметить, что валентность по водороду может также зависеть от других факторов, таких как окружающая среда или наличие других химических элементов. Она может меняться в различных условиях, что влияет на свойства и реактивность вещества.
Примеры валентности по водороду
Принцип валентности по водороду широко используется в химии для определения валентности некоторых элементов. Приведены некоторые примеры валентности по водороду различных элементов:
| Элемент | Валентность по водороду |
|---|---|
| Кислород | 2 (H2O - вода) |
| Азот | 3 (NH3 - аммиак) |
| Сера | 6 (H2S - сероводород) |
| Фосфор | 5 (PH3 - фосфин) |
| Хлор | 1 (HCl - хлороводород) |
| Калий | 1 (KH - гидрид калия) |
Валентность по водороду позволяет определить, сколько атомов данного элемента может соединяться с одним атомом водорода. Эта информация является важной для понимания реакций и составления химических формул.
Пример 1: Водород и кислород
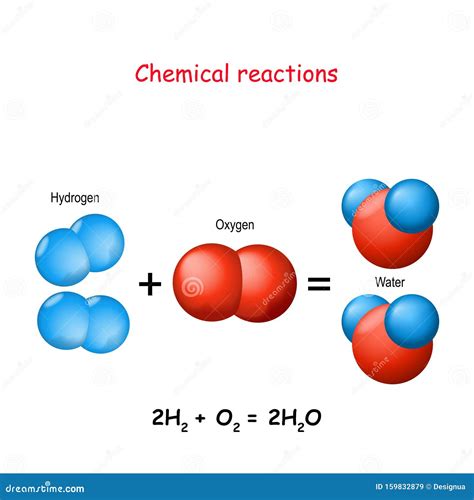
Валентность по водороду равна единице, так как водород может образовывать одну химическую связь с другими атомами. Валентность по кислороду равна двум, так как кислород способен образовывать две химические связи.
В результате реакции между водородом и кислородом образуется молекула воды (H2O). В этой молекуле каждый атом водорода образует одну связь с атомом кислорода, а кислород - две связи с атомами водорода, что соответствует их валентностям по водороду и кислороду.
Пример 2: Водород и азот
Одним из основных примеров такого соединения является аммиак (NH3). В молекуле аммиака атомы азота и водорода связаны ковалентной связью, где атом азота обладает валентностью равной трем, а каждый атом водорода обладает валентностью равной единице.
Кроме того, водород и азот могут образовывать ионы, такие как гидразиновый катион (N2H7+) и азидовый анион (N3-). В гидразиновом катионе водород имеет валентность равную единице, а азот - семь. В азидовом анионе валентность азота равна трем.
Таким образом, валентность по водороду играет важную роль в образовании соединений с азотом. Она позволяет определить количество атомов водорода, которые могут присоединиться к азоту при образовании соединения. Это знание является ключевым для понимания реакций, связанных с водородом и азотом, а также для синтеза и изучения новых соединений и материалов.
Пример 3: Водород и углерод
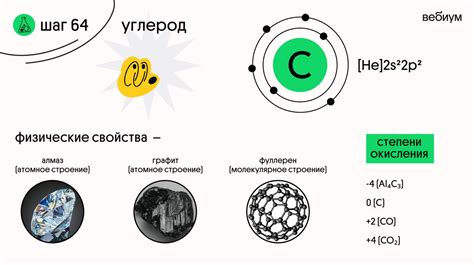
В случае соединения водорода и углерода типичным примером является метан (CH4) – самый простой углеводород. В этом соединении четыре атома водорода связаны с атомом углерода.
Валентность углерода в метане равна 4, что означает, что атом углерода способен установить 4 химических связи с другими атомами. Валентность водорода в метане также равна 1, так как каждый атом водорода может образовывать только одну химическую связь. В результате, формула метана CH4 отражает соответствующие валентности водорода и углерода.
Метан широко распространен как природный газ и является важным энергетическим ресурсом. Он также используется в качестве сырья для получения других органических соединений и применяется в процессе химического синтеза.








