Валентная связь - это основной принцип объяснения химических реакций и образования химических соединений. Она описывает обмен и совместное использование электронов между атомами, которые приводят к формированию связей между ними.
Основные принципы валентной связи основаны на представлении о том, что атомы стремятся достичь наименее энергетически затратного состояния, заполняя свою валентную оболочку. Валентная оболочка атома представляет собой внешний энергетический уровень, содержащий электроны, которые могут участвовать в химических реакциях.
Валентная связь возникает, когда два или более атома обменивают или совместно использовают свои валентные электроны. При этом создается электростатическое притяжение между атомами, которое поддерживает их вместе и определяет химические свойства получившегося соединения.
Валентная связь играет важную роль в объяснении строения и свойств различных веществ - от простых молекул до сложных полимеров. Она позволяет легко предсказывать, какие атомы образуют стабильные соединения и какой тип связи будет между ними.
Валентная связь представляет собой фундаментальный концепт химии, который лежит в основе всех химических процессов в природе и в лаборатории. Понимание ее основных принципов помогает объяснить множество явлений и взаимодействий между атомами и молекулами.
Значение и понятие валентной связи

Основные принципы валентной связи включают:
- Принцип октета - атом стремится иметь полностью заполненную внешнюю оболочку, содержащую 8 электронов.
- Обмен электронами - атомы могут обменивать электроны с другими атомами, чтобы достичь стабильности.
- Образование связи - обмен электронами между атомами приводит к образованию валентной связи.
- Совместное использование электронов - некоторые атомы могут совместно использовать пару электронов, образуя двойную или тройную валентную связь.
Валентная связь имеет важное значение в химии, исследование ее основ и принципов помогает понять, как образуются и взаимодействуют различные молекулы и соединения.
Основные принципы валентной связи
1. Принцип электронной парности: Валентная связь образуется путем обмена или общего использования электронных пар между атомами. Каждая атомная частица стремится достичь электронной конфигурации инертного газа, заполнив свою внешнюю оболочку.
2. Принцип сепарации атомов: Валентная связь устанавливается между двумя атомами благодаря их притяжению друг к другу. Атомы с недостатком или избытком электронов стремятся к сепарации и образованию связи для достижения более стабильной энергетической конфигурации.
3. Принцип насыщенности валентных разъемов: Атомы имеют определенное число валентных разъемов, которые могут быть насыщены электронами другими атомами. Количество валентных разъемов зависит от количества электронов во внешней оболочке атома.
4. Принцип двойной и тройной связи: Валентная связь может быть одинарной, двойной или тройной в зависимости от количества электронных пар, обмениваемых атомами. Двойная и тройная связи обеспечивают большую степень стабильности и кратность валентной связи.
5. Принцип эффективности связи: Валентная связь формируется между атомами с противоположными знаками электрического заряда, чтобы достичь эффективной электростатической равновесии. Атомы с разными зарядами притягиваются друг к другу, создавая стабильную валентную связь.
6. Принцип геометрии молекулы: Валентная связь также определяет геометрию молекулы, так как электронные пары отталкиваются и стараются занимать как можно более удаленные друг от друга положения. Это принципально важно для определения формы и свойств молекулы.
7. Принцип полярности связи: Валентная связь может быть полярной или неполярной в зависимости от разности электроотрицательности атомов. Если разница отрицательности большая, связь будет полярной, что означает неравномерное распределение электронной плотности между атомами.
Основные принципы валентной связи определяют ее природу и свойства. Понимание этих принципов помогает в объяснении химических взаимодействий и реакций, а также в разработке новых соединений и материалов с определенными свойствами.
Роль электронной конфигурации атомов
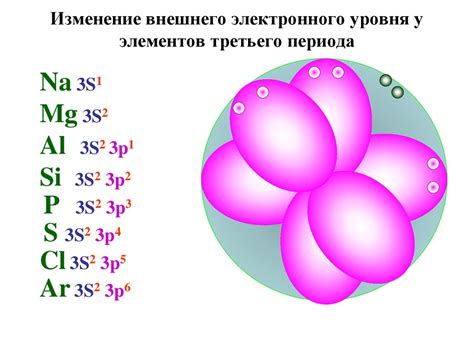
Электронная конфигурация атомов играет важную роль в формировании валентной связи. Валентная связь возникает между атомами, когда их электронные оболочки взаимодействуют друг с другом.
Электроны в атомах находятся на разных энергетических уровнях и обладают разными энергиями. Электроны внешней электронной оболочки, называемой валентной оболочкой, имеют наибольшую энергию и играют ключевую роль в образовании химических связей между атомами.
При образовании валентной связи, электроны валентной оболочки могут быть переданы или поделены между атомами. Атомы стремятся достичь более стабильной конфигурации, при которой их валентные оболочки будут заполнены или вполне заполнены парами электронов. Это достигается за счет образования связи между атомами, а также образования свободных электронных пар.
Наличие свободных электронных пар или образованной связи позволяет атомам приобрести более нейтральное зарядовое состояние и более устойчивую электронную конфигурацию. Валентная связь обеспечивает устойчивость и стабильность химических соединений.
Образование и действие валентной связи
Действие валентной связи заключается в том, что она способна удерживать атомы вещества вместе, образуя молекулы. Она позволяет атомам обмениваться или делиться электронами с целью достижения наиболее устойчивой электронной конфигурации – октета, так как октетная структура является наиболее стабильной для атомов вещества.
Валентная связь приводит к образованию двух основных типов молекул: ионных и ковалентных. В ионной связи атомы образуют молекулы за счет передачи электронов от одного атома к другому, образуя положительно и отрицательно заряженные ионы. В ковалентной связи атомы образуют молекулы за счет общего использования валентных электронов, что позволяет им заполнить свои энергетические оболочки и образовать сильную связь.
Образование и действие валентной связи играют ключевую роль в химии и природных науках, так как они определяют химические свойства и реактивность вещества. Понимание принципов работы валентной связи позволяет ученым предсказывать и объяснять химические реакции и свойства различных веществ.
| Вид связи | Образование | Тип электронного взаимодействия | Свойства |
|---|---|---|---|
| Ионная связь | Передача электрона(ов) | Притяжение разноименно заряженных ионов | Образуются ионы, обладающие зарядом |
| Ковалентная связь | Общее использование валентных электронов | Обмен электронами | Образуется сильная связь между атомами |








