Растворы играют важную роль в мире химии и физики. Это смеси, состоящие из двух или нескольких веществ, где одно вещество, называемое растворителем, растворяет другое вещество, называемое растворенным веществом. Растворы используются повсеместно – от промышленности до нашей повседневной жизни.
Раствор имеет свои уникальные свойства. Он может быть однородным или гетерогенным, прозрачным или мутным. Величина растворенного вещества в растворе называется концентрацией. Существуют различные способы выражения концентрации раствора, такие как массовая, молярная и объемная концентрации.
Физико-химические процессы, происходящие в растворах, являются основой для понимания многих явлений. Одним из таких процессов является диссоциация, когда растворенное вещество разбивается на ионы. Этот процесс играет важную роль в химических реакциях и проводимости электричества в растворах. Еще один физико-химический процесс – реакция между растворенным веществом и растворителем, что может приводить к образованию новых веществ.
Растворы имеют существенное значение во многих отраслях науки и техники: от фармацевтической промышленности до экологии. Изучение свойств и физико-химических процессов растворов помогает нам лучше понимать и контролировать изменения, происходящие в них. Растворы неизбежно встречаются нам на ежедневной основе и знание их свойств является важной составляющей нашей научной и технической грамотности.
Что такое раствор вещества?

Растворы широко применяются во многих областях, включая химическую промышленность, медицину, пищевую промышленность и научные исследования. Вода является одним из наиболее распространенных растворителей благодаря своей широкой доступности и способности растворять множество различных веществ.
Растворы могут быть насыщенными, что означает, что растворимое вещество полностью растворено в растворителе при определенной температуре и давлении. Также существуют разбавленные растворы, в которых содержание растворимого вещества ниже его насыщенности. Растворы могут быть также концентрированными, когда в них содержится большое количество растворимого вещества.
Растворы вещества обладают рядом свойств, которые определяются их составом и концентрацией. В частности, растворы могут быть способны проводить электрический ток (электролиты) или не проводить его (нейтролиты). Они также могут обладать определенными физико-химическими свойствами, такими как кипение, плавление, изменение плотности и изменение цвета.
Описание и определение раствора
Растворы играют важную роль во многих областях науки и нашей повседневной жизни. Они широко используются в химии, физике, биологии, медицине, пищевой промышленности и технологии.
Основные свойства раствора включают прозрачность, однородность и стабильность. Прозрачность означает, что раствор не имеет видимых частиц растворенного вещества. Однородность означает, что раствор имеет одинаковое составление и физические свойства во всех его точках. Стабильность означает, что раствор сохраняет свои свойства на протяжении длительного времени без отклонений или осадка.
Физико-химические процессы, происходящие при растворении, включают диссоциацию, ионизацию и кристаллизацию. В процессе диссоциации растворимое вещество распадается на ионы, например, NaCl диссоциирует на Na+ и Cl-. При ионизации, растворимое вещество, как правило, молекулярное, превращается в ионы под влиянием растворителя.
Растворы могут быть различными по своей концентрации. Концентрация раствора определяется соотношением между массой растворенного вещества и объемом растворителя.
| Типы растворов | Определение |
|---|---|
| Насыщенный раствор | Раствор, в котором количество растворенного вещества достигает насыщения при нормальных условиях. |
| Ненасыщенный раствор | Раствор, в котором количество растворенного вещества меньше максимального количества, которое может быть растворено в данном растворителе при заданных условиях. |
| Перенасыщенный раствор | Раствор, в котором количество растворенного вещества превышает максимальное количество, которое может быть растворено в данном растворителе при заданных условиях. |
Свойства раствора вещества
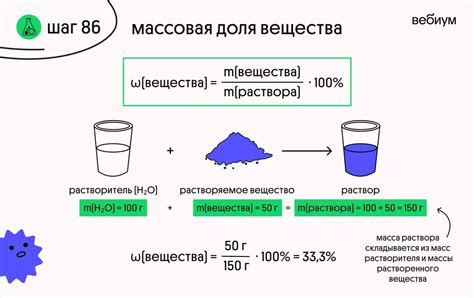
Свойства раствора вещества могут быть разными и зависят от состава раствора и условий его образования. Вот некоторые из них:
- Концентрация: описывает количество растворенного вещества в единице объема или массы растворителя. Концентрация может быть выражена в различных единицах, например, молярностью, мольной долей, процентами по массе или объему.
- Фазовое состояние: раствор может быть в жидком, газообразном или твердом состоянии в зависимости от состава растворимых веществ.
- Вязкость: характеризует сопротивление жидкости к течению. Вязкость раствора зависит от типа растворителя и растворенных веществ, а также их концентрации.
- Электрическая проводимость: некоторые растворы могут проводить электрический ток из-за наличия ионов в растворе. Электрическая проводимость зависит от концентрации ионов и их зарядов.
- Теплопроводность: характеризует способность раствора передавать тепло. Теплопроводность раствора зависит от типа растворителя, его концентрации и температуры.
Эти свойства раствора вещества могут быть использованы для определения его состава, осуществления химических реакций, применения в различных технологических процессах и многого другого.
Физико-химические процессы растворов
Растворы представляют собой гомогенные системы, в которых растворитель (обычно жидкость) содержит растворенное вещество (растворяемое вещество или соль). В растворе происходят различные физико-химические процессы, которые определяют его свойства и характеристики.
Основными физико-химическими процессами растворов являются диссоциация, ионизация, сорбция и экстракция.
Диссоциация - это процесс распада молекулы растворенного вещества на ионы при контакте с растворителем. Диссоциация может происходить как полная, когда все молекулы растворенного вещества распадаются на ионы, так и частичная. Например, при растворении кислоты, молекулы кислоты диссоциируют на протоны и анионы.
Ионизация - это процесс образования ионов из молекулы растворенного вещества путем передачи электронов. Ионизация может происходить как в жидком состоянии, так и при повышенной температуре или под воздействием электрического поля. Например, при ионизации хлорида натрия, молекулы хлорида натрия образуют ионы натрия (Na+) и хлора (Cl-).
Сорбция - это процесс поглощения или накопления вещества на поверхности другого вещества. В растворах сорбция может происходить как на поверхности твердого тела, так и на поверхности жидкого растворителя. Например, при фильтрации раствора через фильтр, твердые частицы остаются на поверхности фильтра и образуют осадок.
Экстракция - это процесс удаления определенного компонента из раствора путем его переноса в другую фазу. Экстракция может использоваться для очистки раствора от примесей или для извлечения ценных компонентов из раствора. Например, при экстракции кофе, растворитель (обычно вода) проникает в поры и вытягивает ароматические соединения из кофейных зерен.
| Физико-химический процесс | Описание |
|---|---|
| Диссоциация | Распад молекулы растворенного вещества на ионы при контакте с растворителем. |
| Ионизация | Образование ионов из молекулы растворенного вещества путем передачи электронов. |
| Сорбция | Поглощение или накопление вещества на поверхности другого вещества. |
| Экстракция | Удаление определенного компонента из раствора путем его переноса в другую фазу. |
Диссоциация веществ в растворах
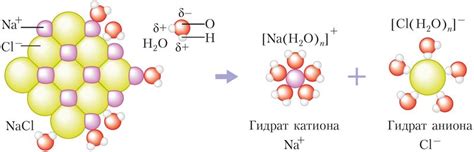
При диссоциации атомы или группы атомов в молекуле вещества разделяются и образуют ионы, которые окружаются солватной оболочкой растворителя. Обычно диссоциация происходит благодаря взаимодействию молекул с молекулами растворителя.
Процесс диссоциации можно представить в виде реакции:
AB → A+ + B-
где AB – исходное вещество, A+ и B- – ионы, образованные в результате диссоциации.
Диссоциация вещества может быть полной или неполной в зависимости от условий растворения. Полная диссоциация означает, что все молекулы вещества разлагаются на ионы, а неполная – что только часть молекул подвергается диссоциации.
Диссоциация вещества играет важную роль в химических реакциях и определяет многие свойства растворов. Она может повышать электропроводность раствора, изменять его физические свойства, влиять на скорость химических реакций.
Знание о диссоциации веществ в растворах позволяет лучше понять многие химические процессы и явления, происходящие в растворах, и установить связь между их составом и свойствами.
Ионный обмен при растворении
Ионный обмен может быть обратимым или необратимым. В случае обратимого ионного обмена ионы вещества и ионы растворителя при взаимодействии образуют новые соединения, которые легко могут раствориться в растворителе. В случае необратимого ионного обмена образуются нерастворимые соединения или выпадает осадок.
Пример: Растворение натрия хлорида (NaCl) в воде – характерный пример ионного обмена. Когда кристаллы NaCl попадают в воду, ионы Na+ и Cl- образуют гидратированные ионы Na+ и Cl-. В это время вода разделяется на гидроксидные и гидронные ионы. Таким образом, происходит ионный обмен между ионами воды и ионами NaCl, что приводит к растворению вещества в воде.
Ионный обмен имеет огромное значение в различных процессах и технологиях. Он используется, например, в области водоочистки, при производстве удобрений и лекарств, а также при получении ионных полимеров и много других областях.
Осмотическое давление в растворах
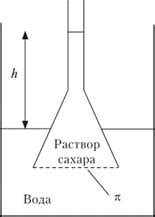
Осмотическое давление играет важную роль в обменных процессах живых организмов и имеет значительное значение в физико-химической характеристике растворов.
Осмотическое давление можно измерить с помощью осмометра, который позволяет определить разность давлений между раствором и растворителем, разделенными полупроницаемой мембраной.
Величина осмотического давления зависит от концентрации растворенного вещества и температуры раствора. Чем выше концентрация раствора, тем выше осмотическое давление. При этом, если концентрации растворов равны, но количество растворенных частиц различное, осмотическое давление будет пропорционально количеству частиц. Осмотическое давление также зависит от температуры: при повышении температуры осмотическое давление увеличивается.
Осмотическое давление играет важную роль в процессах питания растений и животных, а также поддерживает гомеостаз организма. Осмотическое давление также применяется в различных областях науки и промышленности, например, для десалинации воды или при производстве пищевых продуктов.
| Свойства осмотического давления | Описание |
|---|---|
| Зависимость от концентрации раствора | Чем выше концентрация раствора, тем выше осмотическое давление. |
| Пропорциональность количеству растворенных частиц | Если концентрации растворов равны, но количество растворенных частиц различное, осмотическое давление будет пропорционально количеству частиц. |
| Зависимость от температуры | При повышении температуры осмотическое давление увеличивается. |








