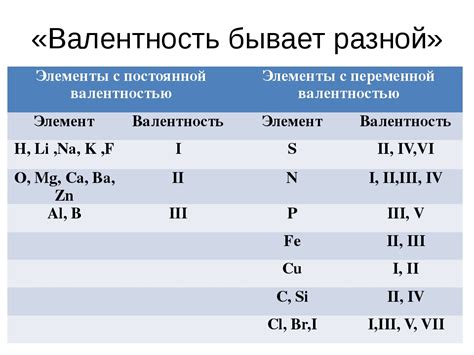
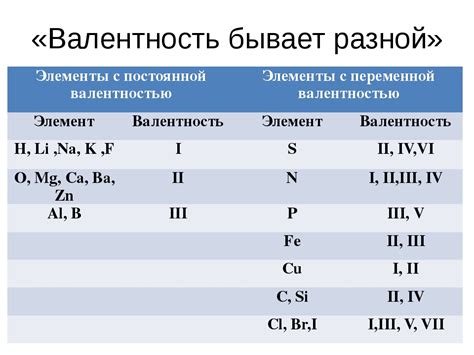
Постоянная валентность - это характеристика элементов химической системы, которая определяет количество электронов, участвующих в химических реакциях. Валентность позволяет описать, как элемент может соединяться с другими элементами и формировать химические связи.
Определение валентности является ключевым шагом в изучении химических реакций и позволяет предсказать, какие соединения могут быть образованы и каким образом они будут взаимодействовать. Валентность может быть постоянной для элементов внутри одной группы или изменяться для элементов из разных групп. Если элемент имеет постоянную валентность, это означает, что он всегда образует одинаковое количество химических связей при реакциях.
Пример: Кислород всегда имеет валентность -2, что означает, что он может образовывать две связи с другими элементами. Алюминий имеет постоянную валентность +3 и всегда образует три связи. В то же время, элементы из групп с переменной валентностью могут иметь несколько разных валентностей, в зависимости от условий. Например, железо может иметь валентность +2 или +3.
Определение валентности основывается на электронной конфигурации атома. Атомы могут стабилизироваться, если имеют полностью заполненные энергетические уровни или имеют внешний энергетический уровень с отсутствием электронов. Взаимодействие атомов происходит путем образования химических связей, при котором атомы делят свои электроны, чтобы достичь стабильности.
Постоянная валентность является важным концептом в химии и позволяет химикам лучше понять и предсказывать химические реакции и свойства соединений.
Постоянная валентность в химии
В химии постоянная валентность означает, что атомы химического элемента могут образовывать химические соединения только при определенном числе связей. Количество связей, которое элемент способен образовать, определяет его валентность и остается постоянным в разных соединениях. Таким образом, постоянная валентность играет важную роль в определении структуры и свойств соединений.
Для определения постоянной валентности элемента необходимо учитывать его электронную конфигурацию. Валентность обычно соответствует числу внешних электронов, которые атом может отдавать или принимать во время химических реакций. Так, элемент с полной внешней электронной оболочкой (например, гелий) имеет валентность 0, так как он не образует связей. Атомы элементов с внешней оболочкой, содержащей восемь электронов, часто образуют связи через обмен электронами, чтобы достичь стабильной электронной конфигурации, известной как правило октаэдра.
Постоянная валентность полезна при предсказании формулы соединений и понимании структуры и свойств вещества. Например, кислород всегда имеет валентность -2, поэтому в воде (H2O), оксиде магния (MgO) или диоксиде углерода (CO2) кислород образует две связи и имеет -2 заряд. Валентность металлов постоянная валентность чаще не подчиняется и может варьировать в разных соединениях.
Таким образом, понимание постоянной валентности является важным аспектом химии, который помогает в определении структуры, связей и свойств соединений. Знание валентности элементов помогает упростить предсказание состава химических соединений и создание новых материалов с желаемыми свойствами..
Определение и примеры
Например, кислород (O) имеет постоянную валентность равную 2. Это означает, что один атом кислорода может образовать две связи с другими атомами. Таким образом, молекула воды (H2O) состоит из одного атома кислорода и двух атомов водорода, каждый из которых образует по одной связи с атомом кислорода.
Другим примером постоянной валентности является азот (N), у которого валентность равна 3. Это означает, что атом азота может образовывать три связи с другими атомами. Таким образом, молекула аммиака (NH3) состоит из одного атома азота и трех атомов водорода, каждый из которых образует по одной связи с атомом азота.
Постоянная валентность имеет большое значение при изучении химии, поскольку она позволяет предсказывать число связей, которые могут образовываться в химической реакции и строить структуры молекул.
Факторы, определяющие постоянную валентность
Постоянная валентность химического элемента определяется несколькими факторами:
| 1. | Конфигурация электронной оболочки. Внешний электронный уровень определяет максимальное количество связей, которое элемент может образовать. Например, элемент с одним электроном на внешнем уровне может образовывать только одну связь, поэтому его постоянная валентность будет равна 1. |
| 2. | Валентность элемента в основных соединениях. Определенные ионы и группы атомов часто встречаются в химических соединениях, и их валентность может быть использована для определения постоянной валентности элемента. Например, постоянная валентность кислорода равна 2, поскольку в основных соединениях кислород образует две связи. |
| 3. | Ионизационная энергия элемента. Ионизационная энергия определяет энергию, необходимую для удаления электрона из атома. Если ионизационная энергия высокая, то элемент будет иметь низкую постоянную валентность, так как стремится сохранить свою электронную структуру. |
| 4. | Размер атома. Обычно, чем меньше размер атома, тем выше его постоянная валентность, так как его электроны находятся ближе к ядру и легче образуют связи. Например, углерод имеет меньший размер, чем кремний, и поэтому его постоянная валентность равна 4, в то время как постоянная валентность кремния равна 4 или 3. |
Все эти факторы влияют на возможные варианты связей, которые может образовать химический элемент, и определяют его постоянную валентность.
Значение и применение
Постоянная валентность имеет большое значение в химии, так как она позволяет определить состав и строение химических соединений. Зная значение постоянной валентности атома определенного элемента, можно предсказать, сколько атомов других элементов он может связать.
Например, зная, что углерод имеет постоянную валентность 4, можно сказать, что один атом углерода может связать с собой четыре атома другого элемента. Это позволяет предсказать количество и типы связей, которые могут образоваться между атомами в химическом соединении.
Постоянная валентность также применяется при построении химических формул и структурных формул. Зная постоянную валентность атомов, можно определить, какие атомы связаны друг с другом и в каком количестве. Это особенно полезно при изучении органической химии, где атомы углерода могут образовывать сложные структуры с большим числом атомов других элементов.
Важно отметить, что постоянная валентность имеет свои ограничения. В некоторых случаях, например, при образовании комплексных соединений, атомы могут иметь валентность, отличную от своего стандартного значения. Однако, в большинстве случаев постоянная валентность является полезным и удобным инструментом для изучения химических связей и структур.








