Нормальность раствора - это концентрация раствора, выраженная в эквивалентах растворенного вещества на литр раствора. Она является одним из показателей концентрации и широко используется в химических расчетах. Нормальность раствора позволяет выявить количественное соотношение между растворенными веществами и их химическими реакциями.
Вычисление нормальности раствора основано на понятии эквивалентности. Эквивалентность определяет количество активного вещества, участвующего в химической реакции. Для вычисления нормальности раствора необходимо знать количество эквивалентов растворенного вещества и объем раствора.
Нормальность раствора (N) вычисляется по формуле: N = (эквивалентность * молярность) / объем.
Нормальность раствора имеет большое значение в химическом анализе, так как позволяет точно определить концентрацию растворенных веществ и проводить расчеты по стехиометрии химических реакций. Вычисление нормальности раствора может быть полезным инструментом как для химиков-исследователей, так и для профессионалов, работающих в химической промышленности.
Что такое нормальность раствора и как ее вычислить?
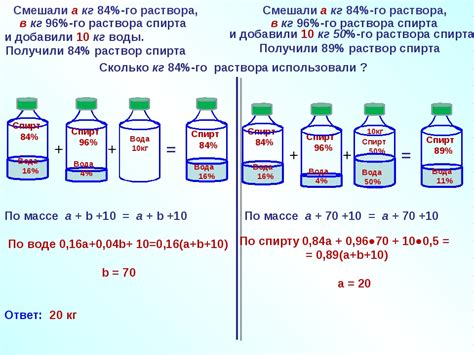
Нормальность (N) раствора вычисляется с использованием следующей формулы:
N = m / (V * E),
где:
- N - нормальность раствора;
- m - масса растворенного вещества в граммах;
- V - объем раствора в литрах;
- E - эквивалентность растворенного вещества.
Эквивалентность растворенного вещества зависит от его химических свойств и может быть определена с помощью балансов химических реакций.
Нормальность является особенно полезной единицей концентрации для реакций, которые протекают пошагово или требуют физического воздействия, такого как осаждение или окисление.
Вычисление нормальности раствора позволяет определить его концентрацию и использовать правильное количество реактива при проведении экспериментов и химических реакций.
Определение нормальности раствора
Для вычисления нормальности раствора необходимо знать количество активного компонента раствора и объем растворителя. Нормальность обозначается символом N и выражается вне системы единиц СИ. Например, N 0.1M означает, что в 1 литре раствора содержится 0.1 эквивалента активного компонента.
Определение нормальности раствора является важным шагом во многих химических расчетах и экспериментах, особенно в аналитической химии. Знание нормальности позволяет учитывать концентрацию активного компонента и производить точные расчеты реакций и взаимодействий веществ в растворе.
Нормальность и концентрация: чем они отличаются?

Концентрация раствора - это показатель количества растворенного вещества, содержащегося в единице объема раствора. Концентрация обычно выражается в молях на литр (моль/л), граммах на литр (г/л) или процентах (%). Определение концентрации раствора может основываться как на массе растворенного вещества, так и на его объеме.
Таким образом, основное отличие между нормальностью и концентрацией состоит в том, что нормальность выражает количество эквивалентов растворенного вещества в единице объема растворителя, а концентрация указывает количество растворенного вещества в единице объема раствора. При расчетах и выборе метода вычисления следует учитывать тип реакции и требуемую точность результатов.
Стандартное состояние и нормальность раствора
В стандартном состоянии нормальность раствора определяется для температуры 25°C и давления 1 атмосфера. Кроме того, стандартное состояние предполагает, что растворителем является идеальный газ. Величина нормальности раствора может быть использована для проведения различных расчетов и определения реакционной способности вещества.
Для вычисления нормальности раствора необходимо знать мольную массу растворенного вещества и объем растворителя. Формула вычисления нормальности раствора имеет вид:
- N = n / V
где N - нормальность раствора, n - количество эквивалентов растворенного вещества, V - объем растворителя в литрах.
Нормальность раствора широко применяется в химических реакциях и аналитической химии, так как она позволяет более точно определить концентрацию вещества и вычислить необходимые расчеты.
Вычисление нормальности раствора по объему и концентрации
Чтобы вычислить нормальность раствора по объему и концентрации, необходимо знать количество вещества в растворе. Количество вещества можно определить, зная концентрацию раствора и его объем.
Нормальность раствора можно вычислить по следующей формуле:
N = (C * V) / V0
где:
- N - нормальность раствора;
- C - концентрация раствора, выраженная в молях вещества на литр раствора;
- V - объем раствора, выраженный в литрах;
- V0 - объем молярного эквивалента вещества, выраженный в литрах.
Таким образом, зная концентрацию раствора и его объем, а также объем молярного эквивалента вещества, можно вычислить нормальность раствора.
Вычисление нормальности раствора по количеству вещества
Нормальность (N) раствора можно выразить формулой:
| N = | кол-во вещества (моль) |
| объем раствора (л) |
Для вычисления нормальности раствора необходимо знать следующие величины:
- Количество вещества (в молях), которое растворено в растворе;
- Объем раствора (в литрах).
Далее, используя формулу для вычисления нормальности, можно получить значение нормальности раствора.
Связь нормальности раствора с химическими реакциями

Когда реакция происходит между растворами, нормальность раствора играет важную роль в определении стехиометрии реакции. Она позволяет определить соотношение между реагентами и продуктами, а также количество реагента, необходимого для достижения определенной степени превращения.
Нормальность раствора вычисляется по формуле:
где
N - нормальность раствора,
C - концентрация растворенного вещества в молях на литр,
V - объем раствора в литрах.
Таким образом, нормальность раствора может быть использована для определения количества реагента, необходимого для проведения химической реакции, и облегчает планирование и проведение химических экспериментов.








