Моль – это фундаментальная единица измерения количества вещества в химии. Она позволяет связать макроскопические и микроскопические свойства вещества. Моль определяется как количество вещества, содержащее столько частиц, сколько атомов содержится в 12 г чистого углерода-12.
С помощью молярных расчетов мы можем выразить количество вещества в граммах, атомах или молекулах. Моль является не только геометрической константой, но и связывает массу вещества с его числом частиц. Используя эту единицу, ученые могут предсказывать результаты химических реакций и оптимизировать процессы синтеза и анализа веществ.
Например, при расчете стехиометрического соотношения реагентов в химической реакции, мы используем информацию об отношении молей различных веществ. Моль также позволяет измерять количество энергии, которое выделяется или поглощается в процессе химических реакций.
Что такое моль в химии?
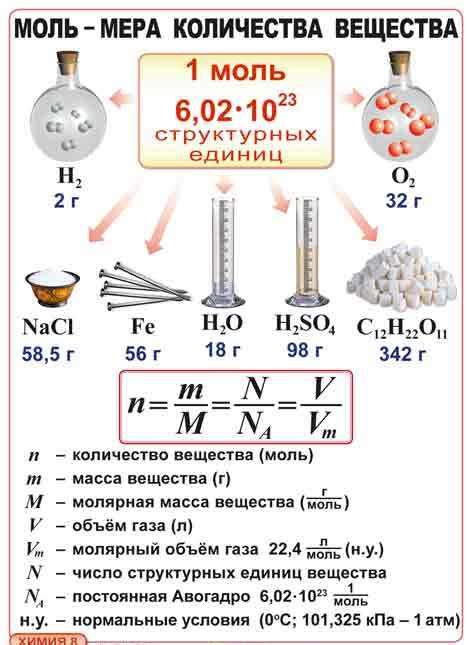
Один моль вещества содержит приблизительно 6,022 x 10^23 частиц. Это число называется постоянной Авогадро.
Моль является удобной единицей для использования в химических расчетах, так как позволяет получать точные результаты и упрощает сравнение различных веществ.
Например, если у нас есть 1 моль кислорода и 2 моля водорода, мы знаем, что они находятся в соотношении 1:2. Это соотношение называется соотношением мольных количеств и позволяет нам определить, какое количество вещества будет образовано при реакции.
Другой пример использования молей - это вычисление массы вещества. Масса одного моля вещества равна его молярной массе. Например, молярная масса кислорода равна 16 г/моль, а молярная масса водорода равна 1 г/моль. Используя это, мы можем вычислить массу 2 моль водорода, которая равна 2 г.
| Vещество | Частицы в одной моли | Приблизительная молярная масса (г/моль) |
|---|---|---|
| Кислород (O2) | 6,022 x 10^23 | 32 |
| Водород (H2) | 6,022 x 10^23 | 2 |
Таким образом, моль - это важное понятие в химии, которое позволяет измерять количества вещества и выполнять различные расчеты. Оно помогает химикам понять и предсказать результаты химических реакций.
Определение и примеры
В химии моль обозначается символом "мол".
Примеры использования моли:
| Вещество | Масса | Моль |
|---|---|---|
| Вода (H2O) | 18 г | 1 моль (6.022 x 1023 молекул) |
| Кислород (O2) | 32 г | 2 моль (1.2044 x 1024 атомов) |
| Глюкоза (C6H12O6) | 180 г | 1 моль (6.022 x 1023 молекул) |
Моль является важным понятием в химии, так как позволяет проводить точные расчеты количества вещества и реакций между ними.
Понятие молярности

Молярность является важным понятием в химии, особенно при изучении растворов. Она позволяет определить, насколько концентрированным является раствор и влияет на многие физические и химические свойства растворов.
Для расчета молярности необходимо знать количество вещества растворенного вещества и объем растворителя. Например, если в 100 мл воды растворено 0,1 моль соли, то молярность раствора будет равна 1 моль/л (M).
Кроме того, молярность можно использовать для определения количества вещества растворенного вещества, если известен объем раствора. Для этого необходимо умножить молярность на объем раствора в литрах. Например, если в 500 мл раствора молярность составляет 0,5 моль/л, то количество вещества растворенного вещества будет равно 0,5 моль/л * 0,5 л = 0,25 моль.
Применение в реакциях
Моль используется в химических реакциях для описания количества вещества, участвующего в превращении. Одна моль вещества содержит Авогадро число частиц (приблизительно 6,022 × 10^23 частиц) и широко используется для выражения стехиометрических коэффициентов в химических уравнениях. Применение молярного понятия позволяет установить соотношения между различными веществами в химических реакциях.
Например, рассмотрим реакцию сгорания метана (CH4) в кислороде (O2):
| Реагенты | Продукты |
|---|---|
| 1 моль CH4 | 1 моль CO2 |
| 2 моля O2 | 2 моля H2O |
Из данного химического уравнения можно сделать вывод, что для полного сгорания 1 моля метана необходимо 2 моля кислорода, что дает 2 моля воды и 1 моль углекислого газа в качестве продуктов. Это соответствует закону сохранения массы и позволяет проводить расчеты по количеству вещества, массе и другим важным параметрам в реакциях.
Молярная масса и мольный объем

Молярная масса вычисляется путем сложения атомных масс всех атомов в молекуле вещества, умноженных на их количество. Например, молярная масса воды (H2O) равна 18 г/моль, так как массы двух атомов водорода и одного атома кислорода составляют 2 г и 16 г соответственно.
Мольный объем, обозначаемый символом Vм, является объемом, занимаемым одной молью вещества при определенных условиях (температуре и давлении). Он вычисляется путем деления объема вещества на его количество вещества в молях. Мольный объем обычно измеряется в литрах на моль (л/моль).
Зная молярную массу и мольный объем вещества, можно рассчитать его плотность, которая представляет собой массу вещества, занимающего единицу объема. Формула для расчета плотности (ρ) выглядит следующим образом: ρ = M/Vм, где М - молярная масса, Vм - мольный объем.
| Вещество | Молярная масса (г/моль) | Мольный объем (л/моль) |
|---|---|---|
| Вода (H2O) | 18 | 22.4 |
| Метан (CH4) | 16 | 22.4 |
| Азот (N2) | 28 | 22.4 |
| Кислород (O2) | 32 | 22.4 |
Связь с плотностью и объемом вещества
Плотность вещества определяется как масса вещества, содержащаяся в единице объема. Плотность обозначается символом ρ (ро) и измеряется в килограммах на кубический метр (кг/м³) в СИ.
Связь молей вещества с его плотностью и объемом можно выразить следующим образом:
Масса = Моль × Молярная масса
Масса = Плотность × Объем
Из двух равенств выше можно получить связь между молярной массой и плотностью вещества:
Молярная масса = Плотность × Молярный объем
Таким образом, плотность и объем вещества могут быть использованы для расчета молярной массы, а молярная масса, в свою очередь, позволяет определить массу и количество молекул или атомов вещества.
Используя эти связи, можно решать различные задачи в химии, например, определять молекулярную формулу вещества или расчеты в реакциях.
Моль в расчетах

В мольной системе измерения количество вещества измеряется в молях, причем 1 моль равен количеству атомов, молекул или ионов, равному числу Авогадро (около 6,022 x 10^23). Таким образом, если у нас есть 1 моль вещества, то мы имеем огромное количество атомов или молекул этого вещества.
Моль также позволяет проводить расчеты в химических уравнениях с учетом соотношения количества вещества. Например, в уравнении реакции указывается, сколько молей реагентов участвует и сколько молей продуктов образуется.
Например, в уравнении реакции горения метана:
CH4 + 2O2 -> CO2 + 2H2O
Можно видеть, что 1 моль метана реагирует с 2 молями кислорода, образуя 1 моль углекислого газа и 2 моля воды.
Такие расчеты позволяют не только определить соотношение веществ в реакции, но и оценить количество вещества, которое будет образовано или реагирует в определенной реакции.
Использование в химической аналитике
Один из примеров использования молей в аналитической химии - определение содержания вещества в образце. Для этого измеряется масса образца и рассчитывается количество вещества в нем, используя молярную массу вещества. Это позволяет определить концентрацию вещества в растворе, процентное содержание элементов в соединении или другие характеристики вещества.
Примером может служить определение концентрации раствора с помощью титрования. В этом процессе метка количества добавляемого раствора основана на молярной массе вещества, растворенного в образце. Зная число моль вещества и объем раствора, можно рассчитать его концентрацию в молях на литр.
Другой пример использования молей в химической аналитике - рассчет молярного эквивалента. Молярный эквивалент обозначает количество вещества, которое может реагировать с одним молью другого вещества. Это позволяет определить отношение между различными веществами в реакции и рассчитать их стехиометрию.
Таким образом, понимание понятия моля и его использование в химической аналитике позволяет проводить различные расчеты количества вещества, концентрации растворов и других характеристик вещества.








