Ионный тип связи - это сильная электростатическая связь между положительно и отрицательно заряженными ионами. Он возникает, когда один атом сильно привлекает электроны другого атома, таким образом создавая заряженные ионы. Ионные связи обычно образуются между металлами и неметаллами, так как металлы имеют тенденцию терять электроны, а неметаллы тенденцию получить их.
Примеры ионных связей включают связь между натрием (Na+) и хлором (Cl-) в хлориде натрия (NaCl), а также связь между кальцием (Ca2+) и фосфатом (PO4^3-) в кальцийфосфате (Ca3(PO4)2). В обоих случаях положительно и отрицательно заряженные ионы притягивают друг друга, образуя стабильные соединения.
Ионные связи являются одной из наиболее сильных связей в химии, и они имеют важные последствия для многих аспектов нашей жизни. Например, ионные связи играют ключевую роль в образовании кристаллических структур, таких как соль и кристаллы минералов. Они также определяют многие свойства веществ, включая их точку плавления и кипения, электропроводность и растворимость.
Важно отметить, что ионные связи могут быть образованы только между частицами с противоположными зарядами. Если все заряды одинаковые, связь будет ковалентной, а не ионной. Ионные связи также могут быть влиянием других факторов, таких как размер ионов и топология кристаллической структуры.
Что такое ионный тип связи?
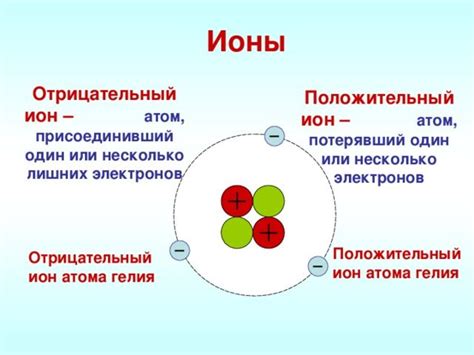
Ионы представляют собой атомы, которые приобрели электрический заряд путем потери или приобретения электронов. Образование ионов происходит вследствие сильного различия в электроотрицательности атомов, что приводит к неравномерному распределению электронной оболочки.
В ионной связи атомы образуют ионы, обладающие противоположными зарядами. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы - анионами. Связь между катионами и анионами осуществляется посредством электростатического притяжения, создавая структуру, называемую ионной решеткой.
Примерами соединений, образующих ионные связи, являются соли, такие как хлорид натрия (NaCl) и сульфат кальция (CaSO4). В этих соединениях натрий и кальций отделяют электроны, образуя катионы, а хлор и сера принимают электроны, образуя анионы, что в итоге приводит к образованию ионных решеток.
Примеры ионных связей в природе
Ионные связи широко встречаются в природе и играют важную роль во многих процессах. Вот несколько примеров, где можно наблюдать ионные связи:
| Пример | Объяснение |
|---|---|
| Кристаллы соли (NaCl) | В кристаллической решетке соли натрия и хлора ионы натрия (Na+) притягиваются к ионам хлора (Cl-) сильными электростатическими силами, образуя структуру кристалла. |
| Щелочные металлы и вода | Когда щелочные металлы, такие как натрий (Na) или калий (K), реагируют с водой, ионы этих металлов образуют связи с ионами гидроксила (OH-) в воде, образуя гидроксид щелочного металла (NaOH или KOH). |
| Аммонийные соли | Аммонийные соли, такие как хлорид аммония (NH4Cl), образуются при реакции аммония (NH4+) с ионами хлора (Cl-) и образуют ионную решетку. |
| Кремний и кислород | Кремний (Si) и кислород (O) образуют ионные связи в кремниевой диоксидной структуре (SiO2), известной как кварц. Ионы кремния (Si4+) и ионы кислорода (O2-) связаны между собой с помощью сильных электростатических сил. |
Это лишь некоторые примеры ионных связей в природе, которые иллюстрируют значимость и влияние ионных связей в различных химических соединениях и материалах.
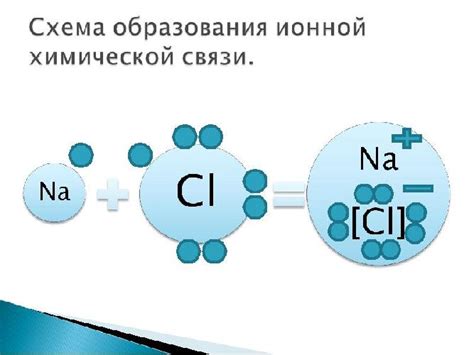
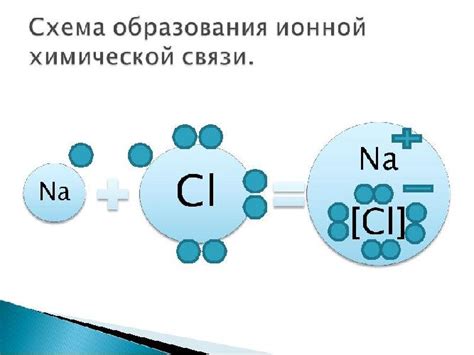
Первый пример ионной связи: натрий и хлорид

Когда натрий и хлорид встречаются, атом натрия теряет свой единственный электрон, становясь положительно заряженным натриевым ионом (Na+), а атом хлора получает этот электрон, образуя отрицательно заряженный хлоридный ион (Cl-). Таким образом, образуются ионы, которые притягиваются друг к другу силой ионной связи.
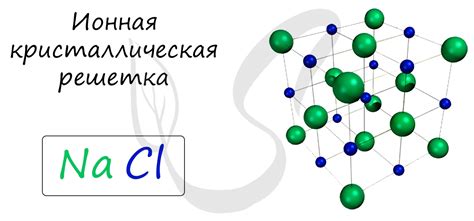
Ионная связь между натрием и хлоридом позволяет образованию кристаллической решетки, которую мы знаем под названием поваренная соль или хлорид натрия (NaCl). В этом кристаллическом веществе каждый натрийный ион окружен шестью хлоридными ионами, а каждый хлоридный ион – шестью натриевыми ионами.
Второй пример ионной связи: кальций и фосфат
Ионы кальция и фосфата сильно притягиваются друг к другу благодаря своим электрическим зарядам. Ион кальция, имеющий положительный заряд, притягивает ион фосфата, имеющий отрицательный заряд, образуя стабильные и долговечные связи.
Эта ионная связь между кальцием и фосфатом играет важную роль в организме. Она обеспечивает прочность и стабильность костей и зубов, способствуя их росту и развитию. Кальций и фосфат взаимодействуют также в процессе образования костных тканей и регулируют метаболизм в организме.
Во многих пищевых продуктах, таких как молоко, сыр, йогурт, содержатся кальций и фосфат, которые важны для поддержания здоровья костей и зубов. Недостаток этих веществ может привести к ослаблению костей и возникновению различных заболеваний, таких как остеопороз.
Третий пример ионной связи: магний и гидроксид
В процессе образования соединения гидроксильные группы OH- отдают свои электроны магнию, образуя положительные ионы Мg2+, а сами становятся OH- ионами с отрицательным зарядом. Таким образом, магний и гидроксид образуют стабильное ионное соединение, в котором между ионами возникают электростатические силы притяжения, называемые ионной связью.
Ионное соединение магния и гидроксида широко используется в промышленности, особенно в производстве гидроксида магния, который применяется в качестве жидкости для желудка и антацидов. Ионная связь между магнием и гидроксидом делает это соединение стабильным и способным продолжительное время сохранять свои химические свойства.
Четвертый пример ионной связи: калий и нитрат
Калий (K) - щелочной металл, а нитрат (NO3-) - анион, состоящий из азота и трех кислородных атомов. При контакте калия и нитрата происходит передача электронов от калия к азоту, образуя положительный ион K+ и отрицательный ион NO3-. Эти ионы притягиваются друг к другу электростатическим притяжением, образуя кристаллическую структуру сетки.
Ионная связь между калием и нитратом является достаточно сильной и стабильной, что делает калийный нитрат широко используемым в сельском хозяйстве, в производстве удобрений и пищевых добавок.
Пятый пример ионной связи: аммоний и карбонат
Ионная связь между аммонием и карбонатом возникает за счет притяжения положительного заряда катиона к отрицательному заряду аниона. В результате этой притяжения образуется прочная и стабильная связь между аммонием и карбонатом.
Аммоний и карбонат могут образовать соль аммония и карбоната (NH4+)2CO3. Эта соль широко используется в различных промышленных процессах и в лабораториях.
Ионная связь между аммонием и карбонатом обусловливает множество химических и физических свойств, которые важны и полезны в различных сферах науки и промышленности.
Шестой пример ионной связи: железо и сульфат
Железо обычно находится в форме двухвалентного катиона (Fe^2+), а сульфат - в форме вторичного аниона (SO4^2-). Ионы железа и сульфата образуют кристаллическую решетку, где катионы и анионы чередуются и образуют прочную связь между собой.
Железо и сульфат могут соединяться в различных соединениях, например, веществах, называемых сульфатами железа. Они находят широкое применение в различных отраслях, включая промышленность, сельское хозяйство и медицину.
Примером сульфата железа является железный сульфат (FeSO4), который используется в качестве добавки в удобрениях, лекарствах и водоочистке.
Седьмой пример ионной связи: медь и оксид
Медь и оксид являются типичным примером ионной связи, где ионы притягиваются друг к другу благодаря притяжению противоположных зарядов. В результате образуется кристаллическая структура соединения, где ионы меди и кислорода распределены в определенном порядке.
Оксид меди (CuO) часто используется в химической промышленности, в процессе производства керамики, электроники и каталитических материалов. Также CuO является важным компонентом в различных химических реакциях и исследованиях, благодаря своим уникальным свойствам.








