Буферный раствор - это раствор, обладающий способностью удерживать постоянную концентрацию ионов водорода (pH) при добавлении к нему кислот или щелочей. Он используется в различных областях науки и техники, где необходимо поддерживать стабильное pH раствора. Буферные растворы часто используются в лабораторных исследованиях, а также в медицине и фармацевтике.
Основным компонентом буферного раствора является слабая кислота или щелочь, которая способна реагировать с добавленными кислотами или щелочами, чтобы удерживать стабильное pH. Например, буферный раствор аммониака и аммиака - это сочетание аммонийной соли и аммиака. При добавлении кислоты к этому раствору аммиак превращается в аммонийную соль, что компенсирует изменение pH и поддерживает его на постоянном уровне.
Буферные растворы широко применяются в биологии и биохимии для поддержания стабильного pH внутри клеток и реакционных сред. Они играют важную роль в множестве биологических процессов, таких как ферментативные реакции и регуляция клеточной активности.
Буферные растворы также используются в аналитической химии и физике для калибровки и измерения pH. Они помогают исключить влияние внешних факторов на точность и повторяемость измерений. Также буферные растворы применяются в фотографии и производстве пленок для стабилизации процесса проявки.
В заключение, буферные растворы играют важную роль в науке и промышленности. Они обеспечивают стабильность pH растворов, что позволяет проводить точные и надежные исследования, а также производственные процессы. Благодаря своим свойствам, буферные растворы нашли широкое применение в различных областях науки и техники.
Определение буферного раствора
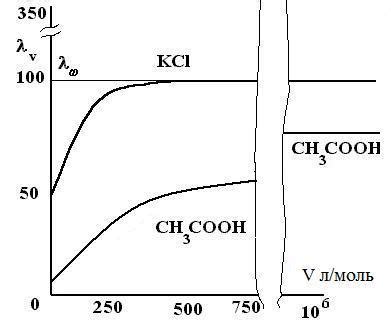
Когда в буферный раствор добавляют слабую кислоту или щелочь, его pH остается относительно постоянным. Это происходит благодаря присутствию равновесной реакции, которая компенсирует изменение концентрации ионов H+ или OH-.
Буферные растворы широко используются в химических и биологических исследованиях, а также в промышленности. Они играют важную роль в многих процессах, включая фармацевтическое производство, анализ биомолекул, калибровку измерительных приборов и создание оптимальных условий для реакций в живых системах.
Состав и свойства буферных растворов
Буферный раствор представляет собой раствор, который способен поддерживать постоянное значение pH при добавлении кислоты или щелочи. Он образуется путем смешивания слабого кислоты и ее соли или слабой щелочи и ее соли.
Состав буферного раствора зависит от выбранных компонентов: слабого кислотного или щелочного компонента и его соли. Например, для создания кислотного буфера можно использовать уксусную кислоту и ее соль - ацетат натрия. Для щелочного буфера можно использовать аммиак и его соль - ацетат аммония.
Основные свойства буферных растворов:
- Способность поддерживать постоянное значение pH: Буферные растворы обладают способностью сопротивлять изменению pH при добавлении кислоты или щелочи. Это связано с наличием ионов, которые реагируют с H+ или OH- и нейтрализуют их.
- Максимальная эффективность вблизи определенного значения pH: Каждый буферный раствор имеет определенное значение pH, при котором он работает наиболее эффективно. За пределами этого значения эффективность может снижаться.
- Широкий диапазон работы: Буферные растворы могут работать в достаточно широком диапазоне pH, что позволяет использовать их в различных химических процессах и биологических системах.
- Устойчивость к разбавлению: Буферные растворы обычно сохраняют свои буферные свойства при небольшом разбавлении, что позволяет использовать их в различных концентрациях.
Буферные растворы широко применяются в химии, биологии и медицине. Они используются для поддержания постоянного pH в различных реакциях, в качестве стабилизаторов и регуляторов pH в биологических системах, а также для калибровки и проверки pH-метров.
Роль ионов в буферных растворах
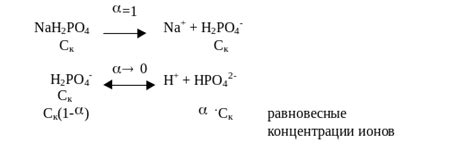
Буферные растворы состоят из смеси слабой кислоты или щелочи и ее солей. Когда буферный раствор находится в равновесии со своими ионами, происходит обратимая реакция между слабой кислотой или щелочью и ее конъюгированной кислотой или щелочью, создавая ионы в растворе.
Роль ионов заключается в поддержании устойчивого pH. В буферных растворах ионы играют важную роль в реакции с добавленными кислотами или щелочами. Когда происходит добавление кислоты, ионы из щелочи реагируют с кислотой и поглощают водородные ионы (H+), чтобы предотвратить сильное изменение pH. Аналогично, когда добавляется щелочь, ионы из слабой кислоты реагируют с гидроксидными ионами (OH-) и поглощают их, чтобы предотвратить сильное изменение pH в щелочную сторону.
Ионы в буферных растворах обеспечивают устойчивость pH, так как реакция между слабой кислотой или щелочью и их конъюгированными формами может происходить в обе стороны. Инициация такой реакции помогает поддерживать постоянный pH раствора в пределах наперед выбранного диапазона.
Таким образом, ионы играют важную роль в буферных растворах, обеспечивая их способность поддерживать устойчивый pH. Без ионов буферные растворы не были бы в состоянии эффективно регулировать pH, что делает их незаменимыми во многих приложениях, где необходимо поддерживать постоянные условия окружающей среды для проведения определенных химических или биологических процессов.
Понятие pH-буфера
Работа pH-буфера основана на принципе автоионизации воды и реакции слабых кислоты с ионами водорода (H+) или слабой щелочи с ионами гидроксида (OH-) в растворе.
При добавлении кислоты в буферный раствор, часть добавленных H+ ионов будет реагировать с ионами гидроксида, образовав вещество с непрерывным pH. А при добавлении щелочи - часть добавленных OH- ионов будет реагировать с ионами водорода, снова поддерживая постоянный pH.
В многочисленных лабораторных и промышленных процессах использование pH-буферов необходимо для точной калибровки и измерения pH-метров, а также для поддержания постоянных условий pH в различных химических и биологических реакциях.
Принцип действия буферного раствора

Принцип действия буферного раствора заключается в двух основных процессах: амфотерное действие слабых кислот и оснований, и диссоциация слабых электролитов.
- Амфотерное действие слабых кислот и оснований: в буферном растворе присутствуют слабая кислота и ее сопряженное основание, или слабая основа и ее сопряженная кислота. В результате этого, когда в растворе добавляют кислоту, слабая основание может принять H+ и превратиться в слабую кислоту, которая нейтрализирует добавленную кислоту. Аналогично, когда в растворе добавляют щелочь, слабая кислота может отдать H+ и превратиться в основание, которое нейтрализирует добавленную щелочь.
- Диссоциация слабых электролитов: в буферном растворе присутствуют ионизированные и нейтральные молекулы слабых кислот или оснований. Когда к раствору добавляются кислота или щелочь, ионизированные молекулы будут склоняться к диссоциации в пределах уже находящейся в среде кислотности или щелочности, что позволяет поддерживать относительно постоянное значение pH.
Принцип действия буферного раствора находит широкое применение в химическом и биологическом анализе, медицине, фармацевтике и других отраслях. Буферные растворы играют важную роль в поддержании стабильности pH в биологических системах, таких как кровь, и обеспечивают точность и надежность результатов анализов и экспериментов.
Применение буферных растворов
Одно из основных применений буферных растворов - в биологии и биохимии. Буферные растворы используются для поддержания постоянного pH окружающей среды, что является критическим фактором для многих биологических процессов. Буферные растворы позволяют поддерживать необходимые условия для проведения реакций и экспериментов, сохраняя стабильность pH.
В аналитической химии, буферные растворы используются для калибровки и контроля pH измерительных приборов, например, pH-метров. Буферные растворы обычно представляются в виде набора растворов с известными значениями pH, которые позволяют проверить и настроить прибор для точных измерений.
В фармацевтической и медицинской промышленности буферные растворы используются для создания оптимальных условий для хранения и транспортировки различных медицинских препаратов и биологических материалов. Благодаря своей способности поддерживать постоянное pH, буферные растворы помогают предотвратить разложение и изменение свойств медицинских препаратов.
Буферные растворы также применяются в химическом синтезе и анализе, а также в процессах обработки пищевых продуктов. Они могут использоваться для регулирования pH реакционной среды и поддержания стабильных условий для эффективной реакции или обработки.
И наконец, буферные растворы имеют широкое применение в научных исследованиях. Они помогают поддерживать константные условия в лабораторных условиях и обеспечивают надежные результаты экспериментов, позволяя исследователям сконцентрироваться на своей работе, минимизируя влияние внешних факторов.








